En cas de dommages, le noyau cellulaire fait appel à des enzymes antioxydantes afin de réparer l’ADN et préserver l’intégrité du génome. Alors que l’on pensait jusqu’ici que le noyau était métaboliquement inactif, cette découverte implique un changement majeur dans notre compréhension de la biologie moléculaire. En outre, la recherche promet de larges perspectives pour de nouvelles stratégies thérapeutiques contre le cancer potentiellement plus efficaces.
Au sein de chacune des milliards de cellules composant notre organisme, se déroulent constamment des réactions chimiques convertissant les nutriments en énergie et en divers composés vitaux. Au cours de ce métabolisme actif, des sous-produits de réaction (espèces réactives de l’oxygène, ou ROS) sont générés et peuvent endommager la structure de l’ADN. Le peroxyde d’hydrogène, l’un de ces composés, détériore par exemple la structure de l’ADN de la même manière que l’eau et l’oxygène corrodent le métal en formant de la rouille. De ce fait, l’ADN est constamment soumis à des mutagènes exogènes et endogènes.
Pour se protéger du « stress oxydatif » et maintenir l’intégrité du génome, les cellules enclenchent systématiquement une cascade de mécanismes leur permettant de réparer les dommages à l’ADN. Ce processus de protection s’effectue par le biais d’enzymes antioxydantes, éliminant les ROS à la source. Il se produit notamment une réaction de réparation spécifique, engagée au niveau de chaque site de la chromatine concerné. Si les dommages semblent irréparables, la cellule concernée déclenche un signal lui permettant de suspendre temporairement ses activités, afin de se concentrer uniquement sur la réparation ou d’entrer en apoptose (autodestruction programmée).
Cette stratégie permet de protéger les 3 milliards de nucléotides composant chaque cellule de mutations potentiellement dangereuses et d’amorcer les mécanismes de défense naturels contre de nombreuses maladies ou anomalies congénitales. Les scientifiques pensaient jusqu’ici que les cellules équilibraient leurs besoins énergétiques et préservaient le génome en contenant les activités métaboliques à l’extérieur du noyau, notamment au niveau du cytoplasme et des mitochondries. Ainsi, l’on pensait que le noyau cellulaire était métaboliquement inactif.
Cependant, la manière exacte dont les perturbations métaboliques peuvent induire des dommages à l’ADN et enclencher un processus d’autoréparation est encore largement incomprise. Les résultats de l’étude, en cours d’évaluation par des pairs et disponible dans la revue Molecular Systems Biology, donnent un nouveau coup de projecteur sur ce mécanisme complexe, en révélant des découvertes inédites.
Les chercheurs, issus du Centre de régulation génomique de Barcelone et de l’Université de médecine de Vienne, ont découvert qu’en cas de dommages généralisés à l’ADN, le noyau se protège en s’appropriant le mécanisme de réparation mitochondrial. Ainsi, contrairement à ce que l’on pensait auparavant, le noyau serait métaboliquement actif. Étant donné que les cellules tumorales détournent le métabolisme cellulaire normal pour une multiplication exacerbée, les résultats de l’étude mettent en lumière de nouveaux indices pour le développement de traitements contre le cancer plus efficaces.
Un indice pour surmonter la résistance aux chimiothérapies
Pour observer ce qui se passe au niveau du noyau cellulaire, les chercheurs ont induit in vitro des dommages à l’ADN de cellules humaines, par le biais de l’étoposide, un médicament couramment utilisé en chimiothérapie. Chez les personnes souffrant de cancer, le traitement vise à endommager l’ADN des cellules cancéreuses en inhibant l’enzyme réparatrice censée maintenir l’intégrité de leur génome. Lorsque suffisamment de dommages s’accumulent, les cellules initient un processus apoptotique.
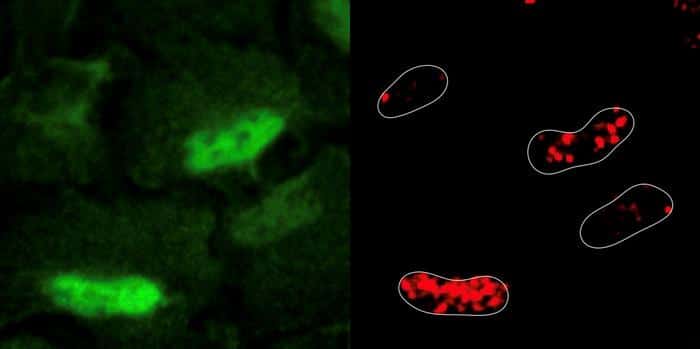
Les experts ont été surpris de découvrir que la génération de dommages à l’ADN a entraîné une accumulation de ROS au niveau du noyau. Les enzymes de la respiration cellulaire (la synthèse d’énergie à partir d’oxygène et de nutriments), des sources majeures de ROS, se déplaçaient depuis les mitochondries vers le noyau pour réparer les dommages à l’ADN au niveau de ce dernier.
« Là où il y a de la fumée, il y a du feu, et là où il y a des espèces réactives à l’oxygène, il y a des enzymes métaboliques à l’œuvre », explique Sara Sdelci, auteure correspondante de l’étude et cheffe d’unité au Centre de régulation génomique de Barcelone. « Notre étude démontre qu’un autre type de métabolisme existe dans les cellules, qui se trouve dans le noyau », indique-t-elle.
Il a été observé que les cellules enclenchaient un processus « ordonnant » à l’enzyme PRDX1 — en temps normal uniquement sécrétée par les mitochondries — de migrer vers le noyau. Grâce à cette enzyme, non seulement les dommages à l’ADN étaient réparés, mais la disponibilité en aspartate (essentielle à la synthèse de nucléotides) a également été améliorée. Il s’agit d’ailleurs de la première observation de ce processus au niveau nucléaire.


Au cours de l’expérience, les gènes impliqués dans la survie de la cellule ont été identifiés par le biais de la technologie CRISPR-Cas9. Les chercheurs ont ensuite découvert que l’élimination des gènes impliqués dans la respiration cellulaire rendait les cellules saines résistantes à l’étoposide. Ce qui signifie que ce médicament, ainsi que ceux agissant par le biais du même mécanisme, pourraient ne provoquer que des effets limités sur les tumeurs. En effet, la plupart des cellules cancéreuses sont glycolytiques, c’est-à-dire qu’elles peuvent effectuer leur métabolisme sans besoin de respiration cellulaire et en présence d’oxygène.
Ces découvertes appellent à l’exploration de nouvelles stratégies contre le cancer, en combinant par exemple l’étoposide avec des molécules stimulant la génération de ROS. Cette option permettrait peut-être de surmonter la résistance aux chimiothérapies. Des inhibiteurs de synthèse de nucléotides pourraient aussi être utilisés pour empêcher la réparation de l’ADN au niveau des cellules tumorales et garantir leur autodestruction.