L’eau se caractérise par trois états physiques — liquide, solide (glace) et gazeux (vapeur) ; elle se trouve dans l’un ou l’autre de ces états selon la température et la pression ambiantes. En cas de refroidissement, elle se transforme en glace ; mais saviez-vous que l’eau peut demeurer liquide jusqu’à au moins -48 °C ? Le processus peut inclure en effet un état intermédiaire dit de surfusion, dans lequel l’eau peut même se trouver sous deux formes liquides différentes, mais dont les limites sont encore mal comprises. Une nouvelle étude permet aujourd’hui de mieux caractériser cette transition de phase liquide-liquide.
L’eau est en réalité très étrange par rapport à d’autres liquides. Pour commencer, la glace d’eau, moins dense, flotte sur l’eau liquide, dont la densité maximale est observée à 4 °C (alors que la plupart des solides s’enfoncent dans leur forme liquide). Sous sa forme liquide, elle est constituée d’un ensemble de molécules d’eau (H2O), maintenues entre elles par des liaisons hydrogène. En fonction de la température et de la pression, la glace d’eau peut adopter quant à elle pas moins de 16 formes cristallines différentes. Mais l’autre curiosité de l’eau est qu’elle peut être refroidie bien en dessous de 0 °C sans se transformer en glace.
La surfusion est un état particulièrement instable dans lequel l’eau demeure en phase liquide alors que sa température est plus basse que son point de solidification. Une étude publiée en 2011 dans Nature a montré que l’eau liquide surfondue ne devient de la glace qu’à la température de -48 °C. À ce point précis, la structure moléculaire de l’eau change pour former un ensemble de tétraèdres (chaque molécule d’eau étant liée à quatre autres). Un nouveau type de transition de phase expliquant ce comportement particulier a été proposé pour la première fois il y a 30 ans, dans une étude menée par des chercheurs de l’Université de Boston. Une nouvelle étude apporte aujourd’hui des preuves de l’existence d’une transition de phase liquide-liquide se produisant dans des conditions de surfusion.
Deux formes liquides plus ou moins denses
Selon la théorie suggérée il y a 30 ans pour expliquer l’origine des anomalies thermodynamiques de l’eau, il existerait une ligne de transition de phase liquide-liquide de premier ordre dans la région surfondue du diagramme de phases de l’eau. Cette ligne séparerait deux phases liquides formées de réseaux de liaisons hydrogène transitoires — un liquide à basse densité (LDL) et un liquide à haute densité (HDL) — et se terminerait à un point critique liquide-liquide.
Si deux états liquides existent dans les conditions de surfusion, il est très difficile de les observer expérimentalement : à ces basses températures, l’eau est dans un état métastable et la moindre perturbation peut déclencher la solidification. L’équipe a donc utilisé des simulations informatiques pour déterminer quelles caractéristiques distinguent les deux liquides au niveau microscopique.
Dans leur simulation, les chercheurs ont utilisé un modèle colloïdal de l’eau, puis deux modèles moléculaires courants de l’eau. Les colloïdes sont des particules qui peuvent être mille fois plus grandes qu’une seule molécule d’eau ; de ce fait, elles se déplacent plus lentement et sont donc souvent utilisées pour observer et comprendre des phénomènes physiques se produisant à des échelles atomiques et moléculaires. « Ce modèle colloïdal de l’eau sert de loupe pour observer l’eau moléculaire, et nous permet de percer les secrets de l’eau concernant ces deux liquides », a déclaré le Dr Dwaipayan Chakrabarti, professeur à l’École de chimie de l’Université de Birmingham et co-auteur de l’étude.
Un enchevêtrement qui pourrait s’observer pour d’autres liquides
Ils ont découvert que les molécules d’eau dans le liquide à haute densité forment des arrangements considérés comme « topologiquement complexes » ; ils évoquent notamment une forme de bretzel ou encore deux maillons d’une chaîne en acier (un lien de Hopf). Dans ce cas, les molécules du liquide à haute densité sont dites enchevêtrées. En revanche, les molécules du liquide à faible densité forment pour la plupart des anneaux simples et, par conséquent, ne sont pas enchevêtrées.
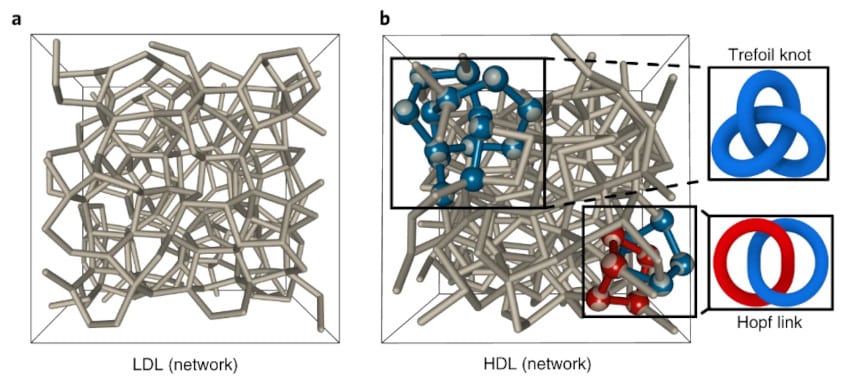
Ainsi, la transition de phase liquide-liquide (LLPT) nouvellement identifiée est la transition d’un réseau moléculaire « non enchevêtré », à un réseau « enchevêtré », composé d’un ensemble de motifs topologiquement complexes. C’est comme si les molécules d’eau, à des températures très froides, se contorsionnaient pour former des nœuds et ne pas se transformer en glace.
« Dans ce travail, nous proposons, pour la première fois, une vision de la transition de phase liquide-liquide basée sur les idées d’intrication des réseaux. Je suis sûr que ce travail inspirera une nouvelle modélisation théorique basée sur des concepts topologiques », résume le professeur Francesco Sciortino de l’université « La Sapienza » de Rome, qui a participé à ces recherches. À noter que Sciortino faisait partie de l’équipe qui a proposé l’existence de la LLPT pour la première fois en 1992.
L’équipe espère que le modèle qu’elle a conçu ouvrira la voie à de nouvelles expériences qui valideront la théorie et étendront le concept de liquides enchevêtrés à d’autres liquides tels que le silicium. En savoir plus sur le comportement topologique de l’eau et d’autres liquides dans ces conditions extrêmes pourrait par ailleurs donner un aperçu de l’activité de la matière sur d’autres planètes.

