C’est un coup de tonnerre dans la communauté scientifique, dans le domaine de la recherche sur Alzheimer, ainsi qu’une sorte de trahison pour tous les malades et leurs proches. 15 ans de recherches reposeraient sur une étude, datant de 2006, dont les conclusions seraient tout simplement fabriquées. Dans les années qui ont suivi, la communauté scientifique a donc tenté de faire progresser la théorie avancée par cette étude frauduleuse du neuroscientifique français Sylvain Lesné, basé aux États-Unis, à savoir que l’accumulation d’un sous-produit des plaques amyloïdes sur les neurones serait majoritairement responsable d’Alzheimer. La conséquence est un gâchis en temps et en argent public pour la recherche et des espoirs qui s’effondrent pour les malades. Des enquêtes complémentaires sont nécessaires. En tout état de cause, cette étude jette un pavé dans la marre des financements de la recherche, parfois plus influencés par la notoriété que par l’intérêt purement médical et humain, et apparemment peu scrupuleux.
Au début des années 2000, plusieurs essais cliniques destinés à l’identification d’un médicament susceptible de combattre la maladie d’Alzheimer ont été lancés. À ce jour, tous se sont révélés malheureusement infructueux. Il faut avoir conscience qu’Alzheimer est une maladie chronique commençant plusieurs dizaines d’années avant l’apparition des premiers signes, touchant l’organe le plus complexe de l’organisme, le cerveau.
Néanmoins, la recherche sur la maladie d’Alzheimer a massivement progressé au cours des 15 dernières années. De nombreuses avancées scientifiques ont pu être réalisées, qui permettent aujourd’hui de mieux comprendre et mieux diagnostiquer la maladie d’Alzheimer, de mieux suivre son évolution et d’identifier de nouvelles cibles thérapeutiques. C’est aussi grâce à ces avancées de la recherche qu’il est possible de mettre en place une prévention efficace afin de retarder l’apparition des premiers signes de la maladie.
Récemment, la revue Science a publié une enquête, menée par Matthew Schrag (Université Vanderbilt) concernant l’une des études les plus citées dans le monde de la recherche sur Alzheimer, et sur laquelle reposent beaucoup d’espoirs thérapeutiques : l’hypothèse des sous-produits toxiques issus des plaques amyloïdes présentes sur les neurones, qui seraient les « grandes responsables » du développement de cette pathologie. Les nombreuses impasses de la recherche depuis 15 ans seraient, selon l’enquête de Science, principalement dues à une hypothèse se révélant beaucoup moins fiable que nous le pensions.
De la manipulation d’images scientifiques au service de la notoriété
L’étude en question est celle du neuroscientifique français, installé aux États-Unis, Sylvain Lesné, publiée en 2006 sous l’égide de l’Université du Minnesota. D’ailleurs, cette dernière vient d’ouvrir une enquête sur le chercheur, à la suite de ces allégations.
Tout a commencé en août 2021, quand un cabinet d’avocats contacte le neurologue et neuroscientifique Matthew Schrag pour examiner les travaux concernant le Simufilam, un médicament anti-Alzheimer développé par le laboratoire américain Cassava Sciences. Cette molécule améliorerait les fonctions cognitives, en partie en « réparant » une protéine, la filamine A, pouvant bloquer les dépôts cérébraux de la protéine bêta-amyloïde (Aβ), une caractéristique de la maladie d’Alzheimer. Ces avocats étaient mandatés par des chercheurs, porteurs d’actions de Cassava Sciences, qui craignaient une fraude sur ces recherches et pour lesquelles ils ont depuis déposé une pétition.
C’est ainsi que Matthew Schrag a commencé un examen minutieux de l’étude sur laquelle prenait appui la conception de ce médicament, celle de Sylvain Lesné et l’hypothèse amyloïde. Puis il a agrandi son corpus d’études suspectes et a trouvé des images manipulées dans des dizaines d’articles impliquant la maladie d’Alzheimer.
Les travaux de Lesné et ses collègues sous-tendent un élément clé de l’hypothèse amyloïde dominante, mais controversée de la maladie d’Alzheimer, qui soutient que les amas d’Aβ, appelés plaques, dans le tissu cérébral, constituent l’une des causes principales de la maladie — plus précisément les sous-produits de ces plaques, appelés « oligomères toxiques ». C’est ainsi qu’ils ont découvert un sous-type Aβ (Ab*56) et qu’ils semblaient prouver qu’il provoquait la démence chez les rats. Si les doutes de Schrag sont corrects, les découvertes de Lesné sont un mirage élaboré.
Comme l’explique Elisabeth Bik, biologiste moléculaire et consultante en imagerie médico-légale, les auteurs « semblaient avoir composé des figures en assemblant des parties de photos de différentes expériences. Les résultats expérimentaux obtenus n’auraient peut-être pas été les résultats souhaités, et ces données auraient pu être modifiées pour… mieux correspondre à une hypothèse ». Mais comme le rappelle Schrag dans l’enquête : « Vous ne pouvez pas tricher pour guérir une maladie. La biologie s’en fiche ».
Pour mettre en évidence la manipulation des résultats, Schrag a analysé des images montrant les niveaux d’Ab*56 de l’article de 2006, augmentant selon l’étude chez les souris âgées à mesure que les symptômes apparaissent. Il y a découvert des bandes étrangement similaires, qui auraient conduit à faire apparaître cet oligomère toxique plus abondant qu’il ne l’était en réalité. De manière concrète, Schrag a fait correspondre le niveau de contraste dans les deux ensembles de bandes suspectes, puis a rendu les arrière-plans noirs pour rendre les bandes plus faciles à voir, et les a colorisés. En dernier lieu, il a fait correspondre précisément leur taille et leur orientation : la superposition est parfaite, beaucoup trop pour qu’il n’y ait pas eu manipulation. Schrag montre un contre-exemple explicite pour valider ses conclusions, où les différences sont, dans ce cas, visibles par superposition.
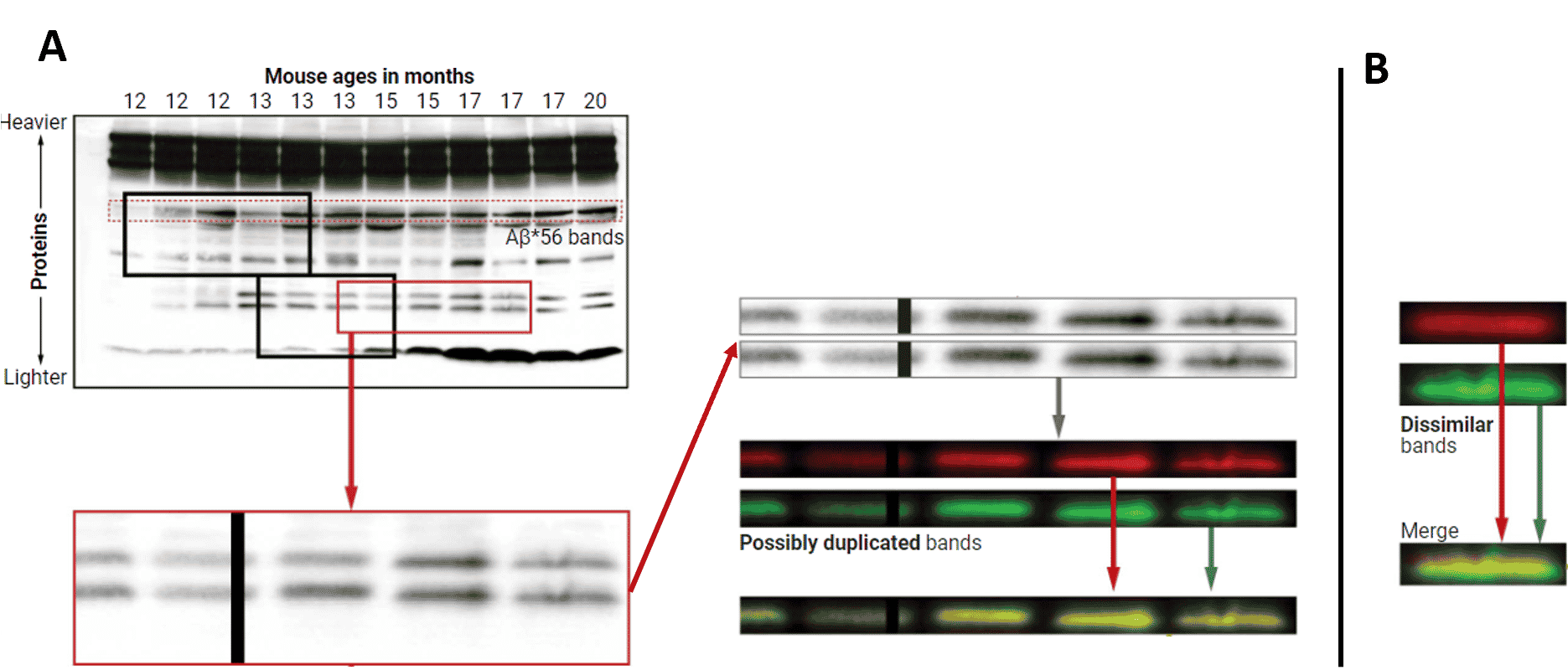
D’ailleurs, Dennis Selkoe de l’Université Harvard, l’un des principaux défenseurs des hypothèses de l’amyloïde et de l’oligomère toxique, déclarait dans deux articles de 2008 qu’il ne pouvait pas trouver Ab*56 dans les fluides ou les tissus humains. Selkoe a examiné le dossier de Schrag sur les articles de Lesné, à la demande de Science. Il n’a pas vu de manipulation dans chaque image suspecte, mais déclare : « Il y a certainement au moins 12 ou 15 images pour lesquelles je conviens qu’il n’y a pas d’autre explication [que la manipulation] ». De nombreuses autres images dans les articles de Lesné pourraient être inappropriées — ce qui est plus que suffisant pour remettre en question l’ensemble de l’œuvre, ajoute Selkoe.
Lesné n’a pas répondu aux demandes de commentaires ou d’informations scientifiques supplémentaires de Science.
Une fraude qui ne remet pas tout en question, mais interroge sur l’objectivité des financements
La conséquence immédiate est bien évidemment le gaspillage de ressources en temps et argent. Néanmoins, il faut bien comprendre que même si la fraude est attestée, tout le travail n’est pas à jeter, encore moins l’hypothèse sur laquelle prenait appui cette étude.
En effet, l’un des plus grands mystères d’Alzheimer est également sa caractéristique la plus distinctive : les plaques et autres dépôts de protéines que le pathologiste allemand Alois Alzheimer a vus pour la première fois en 1906 dans le cerveau d’un patient décédé atteint de démence. En 1984, Aβ a été identifié comme le composant principal des plaques. Et en 1991, des chercheurs ont retracé la maladie d’Alzheimer familiale à des mutations dans le gène d’une protéine précurseur dont dérive l’amyloïde. Selon de nombreux scientifiques, il semblait clair que l’accumulation d’Aβ déclenche une cascade de dommages et de dysfonctionnements dans les neurones, provoquant la démence. Freiner les dépôts amyloïdes est donc devenu la stratégie thérapeutique de choix.
Au début des années 2000, les « oligomères toxiques », des sous-types d’Ab qui se dissolvent dans certains fluides corporels, étaient devenus le principal coupable probable de la maladie d’Alzheimer, potentiellement plus pathogènes que les plaques insolubles. En 2006, l’équipe de l’Université du Minnesotoa, comprenant Lesné, a découvert un type d’oligomère jusque-là inconnu, baptisé Ab*56, en raison de son poids moléculaire relativement élevé par rapport aux autres oligomères, et responsable en grande partie, selon les auteurs, du développement de la maladie d’Alzheimer. Cette étude a redonné de l’entrain aux recherches qui piétinaient et ont fait taire les doutes qui commençaient à surgir face à ces oligomères toxiques dérivés de plaques amyloïdes.
Cependant, des centaines d’essais cliniques de thérapies ciblées sur l’amyloïde ont donné peu de lueurs d’espoir ; seul le décevant Aduhelm a obtenu l’approbation de la FDA. Pourtant, Aβ domine toujours la recherche et le développement de médicaments. Les NIH (National Institutes of Health) ont dépensé environ 1,6 milliard de dollars sur des projets qui mentionnent les amyloïdes l’année dernière, soit environ la moitié de leur financement global pour la maladie d’Alzheimer. Les scientifiques qui avancent d’autres causes potentielles d’Alzheimer, telles que la dysfonction immunitaire ou l’inflammation, se plaignent d’avoir été mis à l’écart par la « mafia amyloïde ».
Mais objectivement, la protéine Ab*56 n’est pas le seul oligomère étudié pour Alzheimer. Le fait que les résultats concernant cet oligomère spécifique soient potentiellement frauduleux n’implique pas que les autres le soient également, et encore moins que l’hypothèse amyloïde soit fausse. En revanche, les chercheurs comprennent maintenant mieux pourquoi personne ne parvenait à répliquer les résultats concernant cet oligomère.
En conclusion, face à des pathologies aussi invalidantes, et représentant un enjeu de santé publique majeur, la multiplication de pistes de recherche est la seule voie possible pour un jour, peut-être, éclaircir les mystères qui entourent encore cette maladie touchant plus de 50 millions de personnes dans le monde. L’enquête met également en exergue les financements, qui devraient être plus éthiques et équitables.


