La perte de la vision dans le glaucome est due à la destruction des cellules ganglionnaires rétiniennes, qui sont directement liées au système nerveux. Chez les souris, un puissant cocktail de médicaments a permis de les régénérer et restaurer la vision avec succès. Beaucoup moins coûteuse que les thérapies cellulaires, l’approche pourrait potentiellement être appliquée à d’autres affections oculaires neuropathiques.
Le glaucome est l’une des causes de cécité les plus fréquentes dans le monde, affectant près de 80 millions de personnes chaque année. Il se manifeste par la perte des cellules ganglionnaires rétiniennes (ou CGR, un type de neurone situé dans la rétine), dont les axones sont directement connectés au cerveau par le biais du nerf optique. Plus précisément, la perte de CGR est due à des lésions au niveau de ces axones, entraînant une atrophie du nerf optique et une perte de vision localisée.
Diverses thérapies sont disponibles pour freiner la progression de la maladie. Cependant, cette dernière n’est généralement diagnostiquée qu’à un stade tardif, lorsque la perte de vision devient trop importante. En effet, elle se manifeste de manière particulièrement hétérogène chez les patients, ce qui la rend difficile à détecter.
L’hypertension intraoculaire est généralement considérée comme responsable des lésions au niveau des axones, soit par compression directe du nerf optique, soit par la réduction du flux sanguin dans la rétine. Cependant, alors que la pression intraoculaire normale se situe entre 11 et 21 mmHg, de nombreux patients présentent une pression supérieure à 21 mmHg sans nécessairement développer un glaucome. D’autre part, environ un tiers des patients glaucomateux ne présentent pas d’hypertension intraoculaire.
Les diagnostics cliniques ont de ce fait tendance à s’appuyer sur la détection des lésions du nerf optique et la perte de vision. À l’heure actuelle, il n’existe aucun moyen de restaurer la vision chez les personnes souffrant de glaucome. Des chercheurs du Children’s Hospital Los Angeles et de l’Université de Californie du sud ont proposé une nouvelle approche dans ce sens, basée sur la régénération des CGR. Leur étude, prépubliée sur la plateforme biorXiv, a montré des résultats prometteurs chez les souris.
Une récupération de la vision dès deux semaines de traitement
D’autres recherches ont précédemment démontré que les cellules gliales de Müller (ou cellules de Müller) peuvent être reprogrammées en neurones rétiniens. Il s’agit d’un type de cellules de soutien rétinien pouvant naturellement se différencier en cellules progénitrices neurales. Ces dernières peuvent, à leur tour, se convertir en neurones fonctionnels pour restaurer la vision suite à une lésion.
Afin d’y parvenir, différentes approches ont été proposées, visant notamment à transplanter directement des CGR dérivés de cellules souches ou des cellules progénitrices neurales, dans la rétine des patients souffrant de glaucome. D’autres travaux suggèrent d’induire une surexpression des facteurs de transcription dans les cellules de Müller pour les convertir en CGR. Cependant, la première technique présente des limites en matière de coûts, sans compter le besoin de recourir aux immunosuppresseurs. Quant à la seconde, elle nécessite l’utilisation de vecteurs viraux, ce qui représente un défi technique majeur.
Afin de surmonter ces obstacles, les chercheurs de la nouvelle étude proposent une approche pharmacologique, en utilisant de petites molécules de reprogrammation cellulaire. Dans une précédente recherche, ils ont notamment démontré qu’une combinaison de 5 petites molécules (appelée 5C) peut reprogrammer les fibroblastes en photorécepteurs. Cela a conduit dans le cadre d’essais à la restauration de la vision chez les souris, après transplantation sous-rétienne.
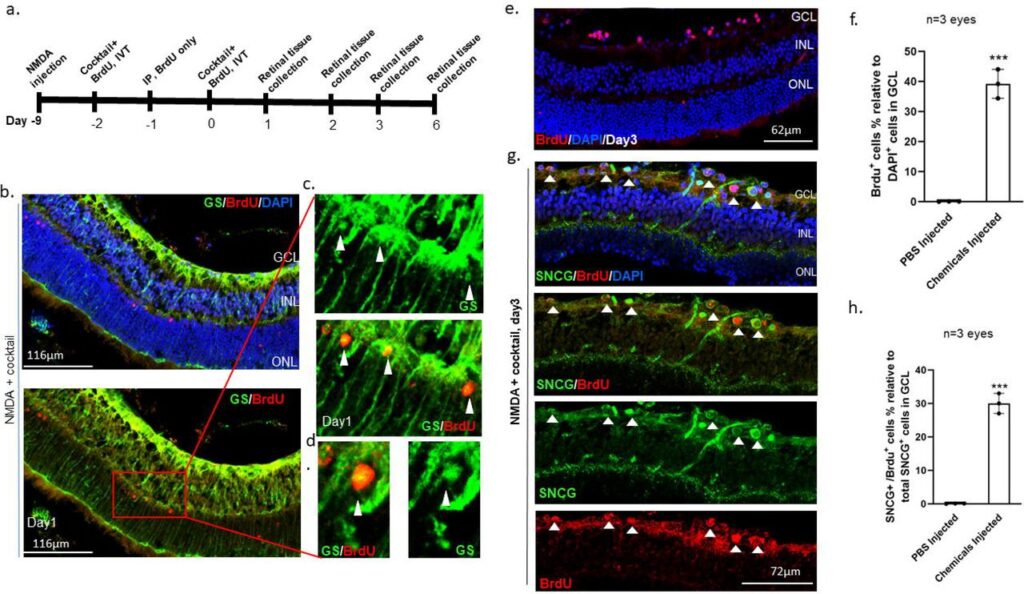
Leur nouvelle approche consiste à améliorer le cocktail 5C avec 3 molécules supplémentaires, de sorte à stimuler la différenciation des cellules de Müller déjà présentes dans la rétine en CGR. Cette approche plus directe permettrait de réduire les difficultés et les coûts liés aux précédents techniques. La thérapie a été testée sur des souris dont les nerfs optiques ont été chimiquement endommagés. Les chercheurs ont constaté un début de récupération de la vision dès deux semaines de traitement.
Pour évaluer l’acuité visuelle des souris, ils ont utilisé « l’expérience de la falaise visuelle », qui consiste à les faire marcher sur une plateforme transparente comportant un trou apparent sur un côté. Au départ, les souris témoins ont presque toutes choisi de marcher du bon côté, tandis que celles malades tombaient systématiquement dans le trou. Cependant, après 45 jours de traitement, 72% des souris traitées sont parvenues à marcher du bon côté de la plateforme. Cette récupération de la vision s’est poursuivie pendant au moins 4 mois, selon les experts.
Après observations microscopiques, les chercheurs ont pu confirmer que les cellules de Müller se sont bien différenciées en CGR, dont les axones se sont correctement étendus vers le système nerveux central. Le même constat a été fait lors de la stimulation in vitro des cellules de Müller.


Toutefois, d’autres essais in vivo sur de plus grands modèles seront nécessaires avant de passer aux essais cliniques. En effet, la réponse au traitement observée chez les souris pourrait ne pas être reproduite chez l’humain, car les axones des CGR doivent croître sur une plus grande distance pour pouvoir atteindre le cerveau. Néanmoins, les résultats semblent prometteurs et les chercheurs prévoient de tester l’approche sur une autre neuropathie oculaire rare, appelée hypoplasie du nerf optique (affectant surtout les enfants). Elle pourrait aussi être appliquée aux personnes dont le nerf optique a été endommagé physiquement ou par une maladie.


