Des chercheurs ont développé un hydrogel révolutionnaire combinant chimiothérapie et immunothérapie pour lutter contre le glioblastome. Testé chez des souris, le gel postopératoire a permis d’atteindre un taux de survie de 100% ! Il pourrait représenter l’approche thérapeutique la plus prometteuse à ce jour contre cette forme très agressive de cancer.
Le glioblastome, l’une des formes les plus courantes de cancer du cerveau, est classé par l’OMS comme tumeur astrocytaire maligne de catégorie 4 en raison de sa forte agressivité. Caractérisé par des cellules cancéreuses très différentes des cellules saines et une évolution rapide, ce cancer affecte généralement 2 à 3 personnes sur 100 000. L’espérance de vie ne dépasse généralement pas 15 à 18 mois après le diagnostic, avec un taux de survie d’environ 5%.
Dans la plupart des cas, les patients décèdent avant que la tumeur n’atteigne un stade métastatique, car elle comprime le cerveau et augmente la pression intracrânienne à mesure qu’elle se développe. La chirurgie est donc la principale recommandation médicale lorsque la masse tumorale est accessible, visant également à améliorer les chances de réussite des traitements médicamenteux postopératoires.
Cependant, comme le soulève Honggang Cui, ingénieur chimique et biomoléculaire de l’Université Johns Hopkins et co-concepteur du nouvel hydrogel, « malgré les récentes avancées technologiques, il existe un besoin urgent de nouvelles stratégies de traitement ». En effet, les glioblastomes ont une forte tendance à récidiver après leur ablation, car environ 10% de cellules tumorales résiduelles persistent, impossibles à retirer complètement par neurochirurgie. Les patients peuvent ainsi présenter des rechutes dans les 9 mois suivant l’opération, même en bénéficiant d’une chimiothérapie ou d’une radiothérapie postopératoire.
La nouvelle étude, publiée dans la revue PNAS, présente un hydrogel conçu pour éliminer les cellules tumorales résiduelles et prévenir la récidive des patients. Composé d’un médicament anticancéreux et d’un anticorps, le traitement allie deux stratégies thérapeutiques distinctes : la chimiothérapie et l’immunothérapie. « Nous ne voyons généralement pas de taux de survie à 100% dans les modèles murins de cette maladie », précise Betty Tyler, professeure de neurochirurgie à l’Université Johns Hopkins et co-auteure de l’étude. Cette combinaison pourrait considérablement améliorer le taux de survie des patients, avec l’espoir d’atteindre un risque de récidive après 5 ans de rémission très faible à la suite de la chirurgie, selon l’experte.
Un hydrogel innovant associant chimiothérapie et immunothéérapie
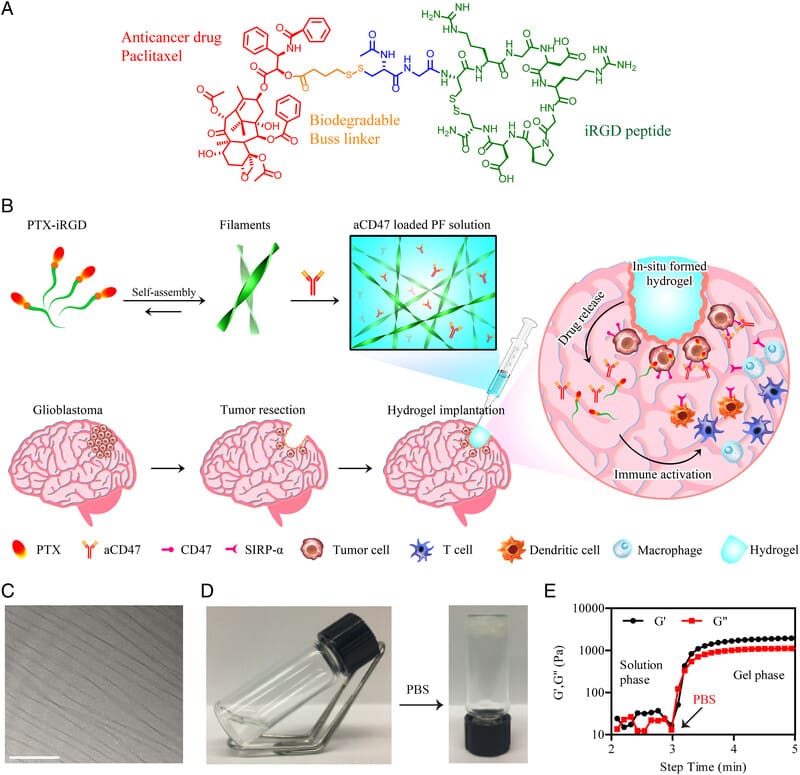
L’hydrogel mis au point par l’Université Johns Hopkins s’autoassemble en filaments nanométriques lorsqu’il est appliqué dans la zone d’ablation de la tumeur (par voie intracrânienne). Cette structure lui permet de pénétrer dans les microsillons inaccessibles par la chirurgie et les médicaments injectés. Les nanofilaments sont composés d’un médicament hydrosoluble appelé paclitaxel (utilisé dans la chimiothérapie du cancer du sein, du poumon et d’autres cancers) et d’un hydrogélateur moléculaire servant à l’administration locale d’anticorps aCD47 (un anticorps macromoléculaire hydrophile). En remplissant uniformément la cavité de résection tumorale, le gel libère avec précision les molécules actives de manière régulière et pendant plusieurs semaines.
Cette combinaison de stratégies, appelée « médicament administré par médicament », est une véritable prouesse, car il est difficile d’associer des médicaments à des anticorps au sein d’un même excipient, en raison de leurs divergences moléculaires. De plus, l’hydrogel surmonte l’un des plus grands défis de la recherche sur le glioblastome, en sensibilisant la tumeur au blocage du signal antiphagocytaire (« ne me mangez pas », ‘Do not eat me’ en anglais) médié par aCD47.
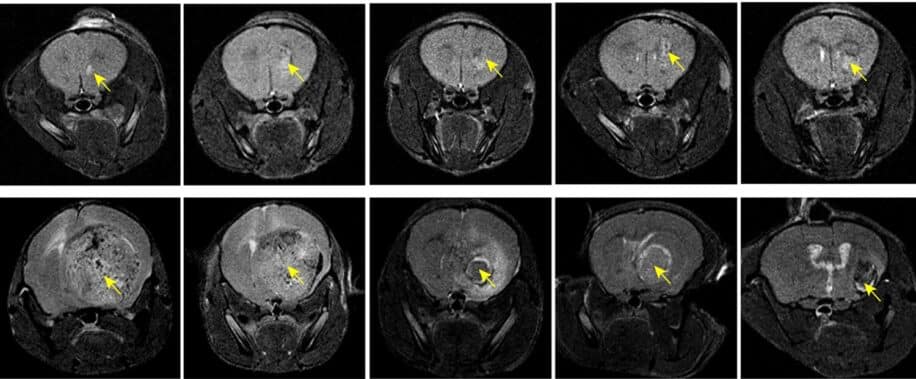
Dans un glioblastome, les cellules tumorales deviennent « intelligentes » et expriment des protéines CD47, créant un microenvironnement immunosuppresseur qui les empêche d’être phagocytées par les macrophages (d’où l’appellation « ne me mangez pas »). Cette adaptation entraîne une croissance tumorale agressive, permettant souvent à la tumeur d’atteindre un stade terminal en seulement quelques mois. Les aCD47 favorisent la création d’un microenvironnement immunostimulant et la phagocytose. Chez les souris, les résultats ont été stupéfiants avec un taux de survie de 100%.
Activation de la réponse « T mémoire »
De plus, il a été constaté que l’hydrogel permettait de réactiver la réponse antitumorale des lymphocytes T, normalement désactivée par l’immunosuppression induite par la tumeur. Confirmant cette observation, les chercheurs ont réintroduit des cellules tumorales chez des souris guéries du glioblastome. Résultat : les souris ont éliminé les cellules tumorales d’elles-mêmes, sans besoin de médicament, grâce à une réponse « T mémoire ».
Cependant, il est important de souligner que le traitement n’est efficace qu’en association avec la chirurgie. L’application directe du gel sans ablation préalable de la tumeur n’aurait entraîné qu’un taux de survie de 50%. Selon les chercheurs, la chirurgie permettrait au système immunitaire de prendre le temps de réapprendre à éliminer les cellules tumorales.
Ces résultats pourraient également varier lors de l’application chez l’homme, sans oublier les effets secondaires liés aux aCD47 signalés dans des recherches antérieures. Néanmoins, les scientifiques estiment que l’hydrogel pourrait potentiellement être utilisé en complément d’autres traitements contre le cancer.
Vidéo de démonstration de l’hydrogel :