Une étude révèle que contrairement à la croyance populaire, les humains transmettent plus de virus aux autres animaux que l’inverse (deux fois plus !). En analysant près de 12 millions de génomes viraux, des chercheurs ont constaté que cette tendance s’appliquait à la plupart des familles virales connues. Les résultats mettent en lumière un mode de propagation interespèce complexe, dont la compréhension permettrait d’améliorer les efforts de prévention des épidémies et de conservation de la biodiversité.
La majorité des maladies infectieuses émergentes et réémergentes chez l’Homme sont causées par des virus transmis par les animaux sauvages ou domestiques. Ces maladies zoonotiques ont provoqué de nombreuses épidémies à travers l’histoire, telles qu’Ebola, la grippe porcine et aviaire. Bien qu’il n’existe pas encore de consensus à ce jour, la COVID-19 est également soupçonnée d’être zoonotique.
Compte de tenue des impacts sur la santé publique, les souches virales potentiellement zoonotiques et les facteurs de transmission font l’objet de surveillances constantes à l’international. Des bases de données et de nombreuses revues systématiques sont élaborées à cet effet.
Ces données ont par exemple permis de démontrer que les virus « généralistes » (qui peuvent infecter un grand nombre d’hôtes) sont généralement associés à un plus grand potentiel zoonotique. D’autre part, les facteurs tels que la croissance démographique et la fragmentation des habitats sauvages due à l’activité humaine augmentent le risque de propagation de zoonoses.
Cependant, malgré les efforts visant à comprendre et à anticiper les transmissions zoonotiques, d’importantes lacunes subsistent. En effet, les humains sont généralement considérés comme des puits de virus et non des sources. La possibilité de transmission virale depuis les humains vers d’autres animaux (maladies anthroponotiques) est ainsi très peu explorée.
Or, des recherches ont démontré que les humains ne sont qu’un nœud au sein d’un complexe et vaste réseau d’hôtes, dans lequel les virus sont fréquemment échangés. Les zoonoses ne représentent peut-être qu’une infime proportion des conséquences écologiques de ces échanges. Par exemple, le métapneumovirus d’origine humaine a provoqué une épidémie respiratoire mortelle chez les chimpanzés en captivité. Un foyer viral de SARS-CoV-2 chez des gorilles du zoo d’Atlanta en 2021 est également soupçonné d’être d’origine anthroponotique.
Le manque de compréhension de cette transmission interespèce pourrait non seulement entraver les efforts de conservation, mais également menacer la sécurité alimentaire. Selon Cedric Tan de l’University College de Londres et du Francis Crick Institute, « lorsque les animaux contractent des virus provenant des humains, cela peut non seulement leur nuire et potentiellement constituer une menace pour la conservation de l’espèce, mais cela peut également causer de nouveaux problèmes pour les humains, avec un impact sur la sécurité alimentaire si, par exemple, un grand nombre d’animaux doit être abattu pour prévenir une épidémie ». Cela s’est notamment déjà produit avec la souche H5N1 de la grippe aviaire.
Afin de combler ces lacunes, Tan et son équipe ont effectué une analyse génomique à grande échelle afin de retracer les sauts d’hôtes des virus (c’est-à-dire le passage à d’autres hôtes) au sein des vertébrés. En effet, ce manque de compréhension « peut provenir en partie du manque d’intégration de la génomique dans les analyses écologiques et phénotypiques », ont expliqué les chercheurs dans leur rapport, récemment paru dans la revue Nature Ecology & Evolution.
« Si un virus transporté par l’homme infecte une nouvelle espèce animale, le virus pourrait continuer à prospérer même s’il est éradiqué parmi les humains, ou même évoluer vers de nouvelles adaptations avant de finir par infecter les humains à nouveau », indique Tan. « Comprendre comment et pourquoi les virus évoluent pour se propager chez différents hôtes à travers l’arbre de vie au sens large peut nous aider à comprendre comment de nouvelles maladies virales émergent chez les humains et les animaux », explique-t-il.
Un phénomène largement sous-estimé
Pour leur enquête, Tan et ses collègues ont analysé environ 12 millions de séquences génomiques virales et les métadonnées des hôtes associés hébergés sur le serveur NCBI. D’autre part, 59 000 séquences isolées de virus infectant différents vertébrés ont été analysées. Ces données ont permis de retracer les sauts d’hôte de 32 familles virales différentes. En outre, les mutations adaptatives caractérisant ces sauts ont également été quantifiées.
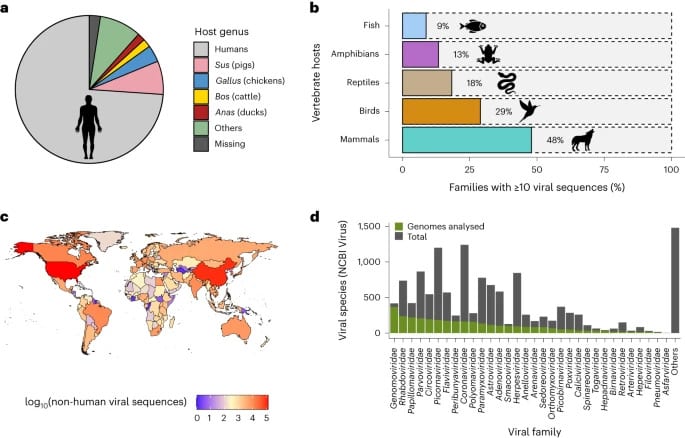


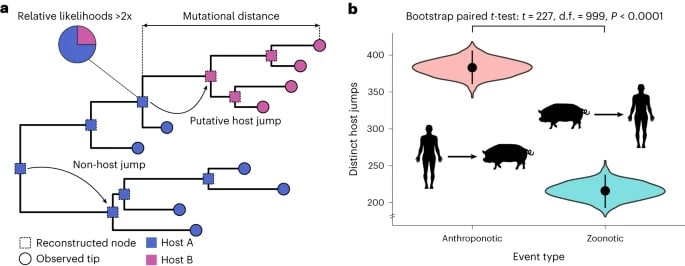
Les chercheurs ont constaté que les transmissions anthroponotiques étaient deux fois supérieures aux transmissions zoonotiques — ce qui met en évidence un fait largement sous-estimé. De plus, une importante proportion de sauts d’hôte d’animal à animal (c’est-à-dire qui n’implique pas les humains) a aussi été observée. De plus, les sauts d’hôte viraux sont associés à une importante augmentation de mutation génétique. Ce taux est nettement supérieur aux mutations observées au cours de leur évolution au sein d’un seul hôte. Cela reflète très probablement la capacité des virus à s’adapter pour mieux infecter de nouvelles espèces.
En outre, les virus ayant déjà infecté de nombreuses espèces présentent des signaux plus faibles de ce processus adaptatif. Cela suggère que les souches pouvant voyager à travers une large gamme d’hôtes possèdent des caractéristiques augmentant intrinsèquement leur capacité à infecter, alors que les autres virus nécessitent des adaptations plus étendues.


Par ailleurs, alors que la pénétration du virus dans une cellule est généralement considérée comme la première étape de l’infection, les analyses suggèrent que le processus est beaucoup plus complexe qu’on le pensait. En effet, l’équipe a aussi découvert que la majorité des adaptations des virus associées aux sauts de l’hôte ne se trouvaient pas au niveau des protéines qui leur permettent de s’amarrer aux cellules hôtes et d’y pénétrer.
Dans l’ensemble, ces résultats indiquent que nous devrions redoubler de vigilance pour la surveillance de la transmission virale interespèces. « En surveillant la transmission des virus entre les animaux et les humains, dans les deux sens, nous pouvons mieux comprendre l’évolution virale et, espérons-le, être mieux préparés aux futures épidémies, tout en contribuant aux efforts de conservation », conclut François Balloux de l’UCL, également auteur de la recherche.


