Les traitements par cellules CAR-T, des techniques utilisant le duo thérapie génique/thérapie cellulaire, ont révolutionné le domaine de la recherche thérapeutique contre le cancer. Cependant, ils présentent encore quelques inconvénients limitant leur accessibilité, notamment au niveau du coût, du temps ex vivo pour modifier génétiquement les cellules et de la durabilité de l’efficacité du traitement. Un nouvel implant biotechnologique, baptisé Multifunctional Alginate Scaffolds for T cell Engineering and Release (MASTER), ambitionne de pallier ces problèmes et présente déjà des résultats prometteurs chez la souris.
Il s’agit d’une petite structure ressemblant à une miniguimauve, qui produit et libère des cellules CAR-T. Cette stratégie avec implant effectue en une journée un processus qui dure habituellement plusieurs semaines pour les traitements conventionnels avec CAR-T, ce qui pourrait permettre, à terme, un gain considérable en temps et en coûts.
Rappelons que les cellules T du système immunitaire sont les sentinelles chargées de traquer et de détruire les cellules infectées par des agents pathogènes. Combinées avec des récepteurs antigéniques chimériques (créés artificiellement), les cellules T deviennent celles dites CAR-T. Véritables armées microbiologiques personnalisées, ces cellules génétiquement modifiées sont conçues pour détecter et détruire les cellules cancéreuses. Elles ont notamment déjà fait leurs preuves dans le traitement de la leucémie infantile et du lymphome chez l’adulte.
Les cellules CAR-T sont en effet personnalisées, car elles sont produites à partir des cellules T naïves (ou inactives) extraites des patients. Pour être activées, ces cellules naïves sont isolées en laboratoire avec des anticorps, pendant quelques jours. Elles sont ensuite reprogrammées en introduisant le gène CAR via des rétrovirus modifiés. On obtient alors les fameuses cellules CAR-T qui ciblent spécifiquement les cellules cancéreuses. Une fois la prolifération des CAR-T stimulée, elles sont finalement introduites par perfusion dans la circulation sanguine des patients.
L’ensemble de ces processus peut prendre plusieurs semaines et s’avère très coûteux. « Un inconvénient majeur du traitement par cellules CAR-T est qu’il est extrêmement coûteux : des centaines de milliers de dollars par dose », confirme Yevgeny Brudno, co-auteur de l’étude et professeur adjoint au département de génie biomédical de l’Université d’État de la Caroline du Nord et de l’Université de Chapel Hill (également en Caroline du Nord).
Ces inconvénients limitent considérablement l’accessibilité aux traitements, qui ne sont certainement pas à la portée de toutes les bourses. D’autant plus que « la réduction du temps de fabrication est encore plus critique pour les patients atteints d’un cancer à évolution rapide », souligne Pritha Agarwalla, auteur principal de l’étude parue dans Nature Biotechnology et chercheur postdoctoral au département de génie biomédical des deux universités. De plus, beaucoup de personnel soignant est sollicité lors du suivi de l’activation et de la différenciation cellulaire ex vivo, ce qui augmente le risque d’hétérogénéité des doses thérapeutiques finales, qui devraient être individuellement adaptées à chaque patient.
Le nouvel implant développé par les deux universités a alors permis de réduire considérablement le temps d’activation des cellules T, leur reprogrammation et leur prolifération, en effectuant ces étapes in vivo (pour le moment chez la souris uniquement). Grâce au MASTER, les lymphomes de ces dernières ont été traités plus rapidement et plus efficacement que lors de traitements par CAR-T standard. De plus, les ressources nécessaires à la conception du traitement sont également réduites.
Rapidité et efficacité à long terme
Pour commencer la conception du nouveau traitement, des lymphocytes T naïfs sont extraits puis mélangés avec des rétrovirus modifiés. L’ensemble est ensuite versé (sur) puis absorbé par l’implant MASTER. Sa structure spongieuse, ses larges pores et sa biocompatibilité permettent aux virus de se lier aisément aux cellules T. La reprogrammation génétique de ces dernières se retrouve ainsi facilitée. La structure est également ornée d’anticorps afin d’activer presque instantanément les cellules T.
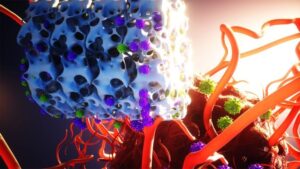
Parallèlement, MASTER est en même temps implanté chirurgicalement. Après l’implantation, l’activation cellulaire se poursuit pour répondre directement après (aux virus modifiés) et pour que les cellules soient reprogrammées en cellules CAR-T. Par ailleurs, l’implant est imprégné d’interleukines qui se dispersent après l’implantation et stimulent la prolifération des CAR-T.
Pour démontrer l’efficacité du traitement, les chercheurs ont traité des souris atteintes de lymphome avec des cellules CAR-T produites et livrées par MASTER. Ce groupe a ensuite été comparé avec un autre groupe traité par la méthode CAR-T classique, et par lymphocytes T non modifiés. « Le résultat final est que les souris qui ont reçu un traitement cellulaire CAR-T via MASTER étaient bien meilleures à combattre les tumeurs que les souris ayant reçu un traitement cellulaire CAR-T conventionnel », déclare Agarwalla.
De plus, les cellules implantées sont plus saines et plus performantes, car elles sont introduites directement dans les heures suivant leur isolement. Plus précisément, MASTER produit des cellules moins différenciées, qui survivent plus longtemps une fois dans l’organisme et sont plus efficaces pour éliminer les cellules cancéreuses. D’après les auteurs de l’étude, l’efficacité anticancéreuse à long terme a été particulièrement prononcée, lorsque les souris ont été confrontées à une récidive de lymphome.
Prochainement, les chercheurs américains prévoient de tester leur implant sur des tumeurs solides, les lymphomes étant liquides. Davantage de recherches doivent également être effectuées avant d’envisager l’application clinique. Et bien que les experts n’aient pas fourni une estimation de coût du traitement par MASTER, ils estiment tout de même qu’il serait moins élevé que celui des thérapies CAR-T classiques.