Des scientifiques ont réussi à transmettre un « super-pouvoir » que possèdent les tardigrades à d’autres organismes vivants !
Les tardigrades, également connus sous le nom d’oursons d’eau, sont des animaux microscopiques (leur taille varie entre 0,1 et 1,5 mm) possédant de nombreuses propriétés extraordinaires. En effet, ils sont extrêmophiles, ce qui signifie que leurs conditions de vie normales sont mortelles pour la plupart des autres organismes. Le tardigrade est par exemple, le seul animal qui puisse survivre dans l’environnement hostile qu’est l’espace. Il peut également supporter d’énormes quantités de radiation, des températures allant de 150°C au presque zéro absolu, ainsi qu’à des pressions six fois supérieures que celles que nous trouverions dans les zones les plus profondes des océans.
Il va sans dire que ces créatures sont surprenantes, et à présent, les scientifiques ont découvert comment profiter de l’un de leurs super-pouvoirs, et de le transférer à d’autres organismes vivants. Il s’agit d’une capacité unique que possèdent ces animaux, qui est celle qui leur permet littéralement de produire du verre vivant.
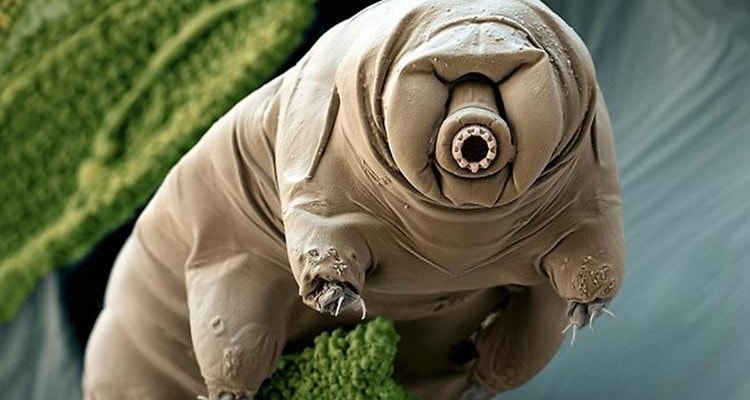
Oui, vous avez bien lu, il s’agit de créer du verre vivant. En fait, cela fait maintenant des années que les scientifiques ont tenté de comprendre comment ces créatures microscopiques peuvent survivre durant des années à une dessiccation extrême, et à la perte de presque la totalité de leur eau. « Ils peuvent rester comme ça, à l’état « sec » pendant des années, voire des décennies, et quand vous les remettez dans l’eau, ils revivent en quelques heures », explique Thomas Boothby, de l’Université de Caroline du Nord. « [Puis] ils courent à nouveau, ils mangent, et ils se reproduisent comme si rien ne s’était passé », ajoute-t-il.
Les chercheurs avaient alors supposé que leur survie dépendait d’un sucre appelé tréhalose, sucre dont se servent les artémies, des petits crustacés, pour préserver leurs cellules durant une dessiccation. Mais la récente recherche a démontré que les taux de tréhalose étaient beaucoup plus faibles chez les tardigrades desséchés que chez les artémies, de sorte qu’il est impossible qu’il s’agisse du même procédé.
En réalité, il s’avère que ce que Boothby et ses collègues ont découvert en 2015, était bien plus étrange que ce qu’on aurait pu croire : les tardigrades produisent un type de « bioverre » qui maintient les protéines et les molécules essentielles en suspension, jusqu’à ce qu’elles soient réhydratées. En gros, les tardigrades s’enveloppent d’un type de verre vivant lorsqu’ils sont desséchés, et de l’eau ordinaire suffit pour faire revenir leurs protéines et autres molécules vitales à la normale.
Depuis l’identification des protéines responsables de cette production de bioverre, appelées protéines intrinsèquement désordonnées (intrinsically disordered protein – IDP), Boothby et son équipe ont compris qu’ils pourraient transmettre cette capacité à transporter les protéines, à d’autres créatures, leur permettant à leur tour de survivre à une dessiccation.
Comme l’indique leur nom, les protéines intrinsèquement désordonnées sont sans forme (et manquent donc de structure tridimensionnelle stable), ce qui leur confère une forte plasticité dans des conditions normales. Mais lorsqu’un dessèchement extrême survient, leur production se met littéralement en veille, et les protéines se réarrangent alors en verre biologique solide.
Puis, ces nouvelles structures de verre créées grâce aux IDPs ciblent certaines protéines, molécules, et autres cellules vitales lorsque le tardigrade commence à perdre son eau et les enferment dans des sortes d’enveloppes rigides et protectrices, leur permettant de ne pas s’écrouler lors du processus de dessiccation. Si le tardigrade est ensuite exposé à de l’eau, le verre fond littéralement et les IDPs reprennent leur état d’origine.
Ces protéines sont donc essentielles pour que les tardigrades puissent survivre à une dessiccation. Lorsque Boothby et son équipe ont effectué des tests et ont inséré ces gènes dans des bactéries, ils ont constaté que les protéines les protégeaient de la dessiccation extrême, tout comme pour les tardigrades. « Les protéines intrinsèquement désordonnées spécifiques aux tardigrades sont nécessaires pour les protéger de la dessiccation, mais ils augmentent également la tolérance à la dessiccation lorsqu’ils sont placés dans des bactéries et des levures », explique Boothby. « Étonnamment, les IDP spécifiques aux tardigrades sont suffisants même dans un tube à essai pour protéger du matériel biologique purifié, comme des enzymes sensibles à la dessiccation. On pense que le verre solide qu’ils forment recouvrent les molécules sensibles à la dessiccation et les empêchent physiquement de se briser, de se déployer ou de fusionner », ajoute-t-il.
Bien que ces travaux aient beaucoup fait parler d’eux ces dernières années, nous ne pouvions pas être certains des résultats, car les études n’avaient pas encore été vérifiées de manière indépendante par les pairs. Mais à présent, c’est chose faite : les résultats de l’équipe ont été publiés officiellement ! Nous pouvons désormais exploiter les super-pouvoirs des tardigrades.
Ce qui sera intéressant maintenant, c’est de découvrir si ces IDP spécifiques aux tardigrades pourront être utiles chez des organismes plus grands et complexes que des bactéries ou des levures. Et l’équipe suppose que cela pourrait être possible. En effet, lorsque les chercheurs ont décidé de tester le gène qui contrôle la production d’IDPs dans des cellules épithéliales humaines spécialement conçues à cet effet, ils ont découvert que celui-ci produisait du bioverre lors de la dessiccation. Une autre étude datant de l’année dernière a également démontré que la protéine qui protège les tardigrades des radiations peut être transférée à des cultures de cellules humaines.
D’autres applications potentielles incluent le développement de cultures qui pourraient survivre à des sécheresses intenses et prolongées, voire des médicaments qui pourraient enfin être stockés à des températures ambiantes, au lieu de devoir constamment être refroidis (ce qui rend extrêmement difficile l’approvisionnement de ces médicaments dans les communautés éloignées et en développement). « Personnellement, je trouve que c’est important de pouvoir être en mesure de stabiliser des produits pharmaceutiques sensibles dans un état sec. J’ai grandi en Afrique, où le manque de réfrigération dans les régions éloignées est un énorme problème. Ces applications du monde réel sont l’une des choses qui m’ont amené à étudier les tardigrades », a conclu Boothby.


