Des chercheurs ont réussi à observer en direct les modifications neuronales liées à la mémoire. Cette percée, réalisée par l’Institut néerlandais des neurosciences, révèle comment les neurones adaptent leur forme pour renforcer leurs connexions. L’étude met en lumière la plasticité du segment initial de l’axone et son rôle dans la régulation mémorielle. Ces découvertes pourraient influencer la recherche sur les troubles neurologiques associés à la mémoire.
La mémoire, cette capacité fondamentale qui nous permet de stocker et de rappeler des informations, est au cœur de notre identité et de notre expérience humaine. Bien que sa nature complexe ait été étudiée pendant des décennies, il reste encore beaucoup à découvrir sur les mécanismes précis qui la sous-tendent.
Récemment, des chercheurs de l’Institut néerlandais des neurosciences ont franchi une étape significative en visualisant en temps réel un processus essentiel à la formation de la mémoire. Cette percée, qui concerne la manière dont les neurones modifient leur forme pour renforcer leurs connexions, pourrait éclairer notre compréhension des fondements biologiques de la mémoire. L’étude est disponible dans la revue Science Advances.
La plasticité du segment initial de l’axone
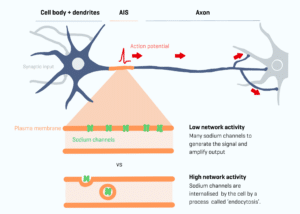
Au cœur de cette découverte se trouve le segment initial de l’axone (AIS), une partie spécifique du neurone. La plasticité de cet AIS, c’est-à-dire sa capacité à changer en fonction de l’activité neuronale, joue un rôle crucial dans la manière dont les neurones transmettent des informations. Plus précisément, cette plasticité permet aux neurones d’ajuster leur réponse, ou potentiel d’action, en fonction des variations d’activité du réseau neuronal.
Nora Jamann, co-auteure, déclare dans un communiqué : « Lorsque vous apprenez, l’activité du réseau neuronal fluctue constamment. Les neurones doivent fonctionner avec des variations extrêmes de niveaux d’activité : une activité trop faible ou trop élevée peut nuire à la formation de la mémoire ». Les auteurs expliquent que des expériences précédentes sur des souris ont illustré cette adaptabilité : une souris aux moustaches coupées reçoit un apport sensoriel réduit. En conséquence, le nombre de canaux sodiques dans l’AIS augmente pour maintenir l’équilibre.
L’inverse se produit également : s’il y a trop d’entrées, comme lorsque la souris est placée dans un nouvel environnement avec une activité élevée, l’AIS devient légèrement plus court et possède moins de canaux sodiques. Mais comment cela fonctionne et à quelle vitesse cette plasticité se produit ont toujours été des questions fondamentales pour les neuroscientifiques.
Une visualisation en direct
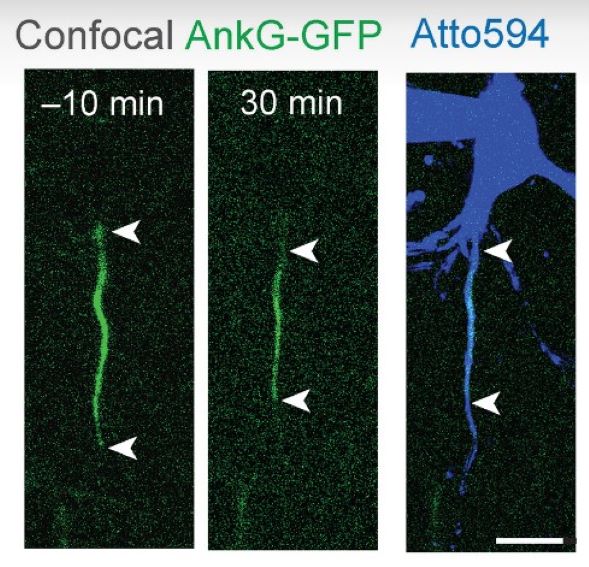
Amélie Fréal déclare : « Pour répondre à cette question, nous avons été confrontés à un défi de taille : comment capturer la plasticité en direct ? Si vous vous demandez comment l’AIS s’adapte, vous voulez réellement le voir bouger. Cela n’était pas possible auparavant sur le terrain. Dans cette recherche, nous avons utilisé deux nouveaux outils ».
D’une part, les auteurs ont utilisé un modèle de souris spécial avec l’AIS marqué d’une protéine fluorescente, permettant d’observer le mécanisme et d’enregistrer les changements temporels dans des tranches de cerveau. D’autre part, ils ont utilisé des outils moléculaires rendant visibles les canaux sodiques dans les cultures cellulaires. Cela a permis de suivre en direct les canaux sodiques pour la première fois.
Rôle des canaux sodiques dans la communication neuronale
L’étude détaille les mécanismes moléculaires à l’œuvre. Lorsque le récepteur N-methyl-d-aspartate (NMDA), une protéine spécifique présente dans les neurones, est activé, cela entraîne des phénomènes majeurs, dont une dépression synaptique à long terme, c’est-à-dire une diminution de l’efficacité de la transmission de l’information entre les neurones.
Concrètement, les chercheurs ont observé l’internalisation rapide (endocytose) des canaux sodiques présents dans l’AIS. Ces canaux, qui permettent le passage des ions sodium, sont essentiels à la génération du potentiel d’action des neurones. En effet, lorsqu’un neurone reçoit une stimulation, ces canaux s’ouvrent, permettant aux ions sodium d’entrer dans la cellule. Cette entrée rapide provoque une modification rapide de la polarité électrique de la cellule, générant ce que l’on appelle un potentiel d’action. C’est ce potentiel d’action qui se propage le long du neurone et permet la transmission de l’information.
L’initiation de ce potentiel d’action, c’est-à-dire son déclenchement, est un processus finement régulé. Les canaux sodiques, par leur ouverture et leur fermeture, déterminent précisément quand et comment ce potentiel d’action est généré.
Dans le contexte de l’AIS distal, l’endocytose des canaux sodiques signifie que ces canaux sont retirés de cette zone spécifique du neurone. Avec moins de canaux sodiques disponibles, le neurone nécessite une stimulation plus importante pour déclencher un potentiel d’action. Cette modification du seuil de génération du potentiel d’action influence la manière dont les neurones communiquent entre eux et, par conséquent, la manière dont l’information est traitée et transmise dans le cerveau.


Implications pour la recherche sur la mémoire
En comprenant mieux ces modifications structurelles et fonctionnelles, les chercheurs peuvent donc approfondir leur connaissance des mécanismes qui permettent au cerveau d’acquérir, de stocker et de rappeler des informations.
Ces découvertes ouvrent également des perspectives thérapeutiques. Les troubles de la mémoire, qu’ils soient liés à des maladies neurodégénératives comme la maladie d’Alzheimer, à des lésions cérébrales ou à d’autres affections, peuvent avoir des origines variées. Or, les résultats de l’étude offrent la possibilité de cibler plus précisément les dysfonctionnements à l’origine de ces troubles.
Ainsi, en identifiant comment les neurones adaptent leur forme et leur fonction, il pourrait être possible de développer des interventions qui stimulent, modulent ou rétablissent ces mécanismes adaptatifs. Que ce soit par des approches pharmacologiques, des interventions non invasives comme la stimulation magnétique transcrânienne ou d’autres méthodes, cette compréhension approfondie pourrait conduire à des traitements plus efficaces et ciblés pour les troubles de la mémoire.
VIDÉO : Enregistrement en accéléré d’un neurone en entier, montrant l’AIS marqué par AnkG-GFP, filmé toutes les cinq minutes de 0 à 60 minutes après l’application de NMDA pendant 3 minutes, suivie de l’application d’APV (antagoniste spécifique des récepteurs NMDA) pendant 5 minutes. On peut voir une pipette dans le coin supérieur gauche. L’imagerie a été réalisée avec un disque confocal en rotation. Les images ont été ajustées en contraste et alignées dans le temps. Échelle : 15 µm. © A. Freal et al., 2023