Le dostarlimab, une nouvelle immunothérapie contre le cancer qui a montré une efficacité de 100 % lors d’essais cliniques, devrait bientôt être approuvé par la Food and Drug Administration américaine (FDA). Recevant la désignation de « thérapie révolutionnaire », le médicament a permis d’éliminer les tumeurs rectales sans recours à la chirurgie ni à la chimioradiothérapie. Cette désignation devrait faciliter et accélérer le processus de mise sur le marché.
Le cancer du rectum (ou adénocarcinome rectal) fait partie du groupe des cancers colorectaux, la troisième forme de cancer la plus diagnostiquée au monde. Environ 5 à 10 % des cancers du rectum sont dits « localement avancés avec déficit de réparation des mésappariements » (dMMR/MSI-H), en raison de la présence d’anomalies génétiques affectant la réparation de l’ADN lors de la réplication cellulaire. Le déficit de réparation des mésappariements constitue un excellent biomarqueur pour prédire la réponse aux immunothérapies. De plus, ce biomarqueur est également présent au niveau d’autres tumeurs gastro-intestinales, des tumeurs de l’endomètre, ainsi que d’autres tumeurs solides.
Le dMMR/MSI-H est généralement traité par le biais d’une combinaison de chimiothérapie et de radiothérapie, suivie d’une chirurgie. Les hôpitaux proposent généralement une chimiothérapie d’induction (visant à éliminer le plus de cellules cancéreuses possible) avec de la fluoropyrimidine en association avec de l’oxaliplatine, suivie d’une autre étape de chimioradiothérapie puis d’une chirurgie.
Cependant, alors que les résultats initiaux sont positifs pour la majorité des patients, près d’un tiers décèdent d’une métastase à distance au cours des années suivant leur traitement. D’autre part, la chirurgie et la toxicité de la chimioradiothérapie peuvent entraîner des impacts négatifs à long terme sur la qualité de vie des patients, provoquant notamment des troubles intestinaux et urinaires, des cancers secondaires et une infertilité. En effet, la résection du rectum implique généralement une colostomie de dérivation permanente (retrait du rectum et fermeture complète de l’anus par le biais de points de suture).
Développé par le géant britannique de l’industrie pharmaceutique GlaxoSmithKline (GSK), le dostarlimab (commercialisé sous le nom de Jemperli) contourne ces obstacles en étant administré seul, sans besoin de chirurgie ou de chimioradiothérapie. Après avoir bénéficié l’an dernier de la procédure « Fast Track » (permettant de réduire les délais d’autorisation d’essais cliniques), le médicament a désormais obtenu la « Breakthrough Therapy Designation » (thérapie révolutionnaire) de la FDA.
« La désignation d’aujourd’hui, qui repose sur le taux de réponse clinique complète sans précédent de 100 % du dostarlimab, appuie une voie visant à contribuer à changer le paradigme thérapeutique des patients atteints d’un cancer rectal localement avancé, qui sont confrontés à des effets indésirables à long terme sur leur qualité de vie », explique dans un communiqué récent Hesham Abdullah, vice-président senior et responsable mondial du département de recherche et de développement en oncologie chez GSK.
Une absence de récidive constatée jusqu’à 4 ans après le traitement
Le dostarlimab est un anticorps bloquant le récepteur de mort cellulaire programmé de type 1 (anticorps monoclonal anti-PD-1). Ce récepteur joue un rôle essentiel dans l’inhibition des réponses immunitaires en modulant l’activité des lymphocytes T et en activant leur apoptose ainsi que celle des lymphocytes T régulateurs. Des études ont montré que le déficit en réparation des mésappariements est associé à une dérégulation du récepteur PD-1.
Dans le cadre des derniers essais, le traitement a été administré toutes les 3 semaines pendant 6 mois à 42 patients atteints d’un dMMR/MSI-H de stade 2 et 3, au Memorial Sloan Kettering Cancer Center (MSK). Les patients présentant une réponse clinique complète (100 %) à la fin de cette période ont poursuivi leur traitement sans chimioradiothérapie ni intervention chirurgicale. Le taux de réponse complète se traduit par une élimination totale de la tumeur telle qu’évaluée par imagerie par résonance magnétique, endoscopie et examen rectal numérique, par tomographie par émission de positons (TEP), ainsi qu’une absence de récidive pendant les 12 mois suivant la fin du traitement.
D’après les résultats, détaillés dans New England Journal of Medicine, la totalité des patients a enregistré une réponse clinique complète et aucune récidive n’a été signalée au cours des 6 à 25 mois de suivi. Ces essais ont été précédés d’un autre incluant 24 patients qui ont présenté des réponses similaires. « Ce nouveau traitement s’avère très durable », a déclaré dans un précédent communiqué (datant de juin 2024) Andrea Cercek, oncologue gastro-intestinale au MSK et auteure principale de l’étude. « La plupart des personnes participant à l’essai n’ont plus de cancer depuis au moins un an, et les participants initiaux sont en bonne santé depuis quatre ans. Le taux de réussite reste de 100 % », indique-t-elle. Les effets secondaires sont légers et généralement bien tolérés.
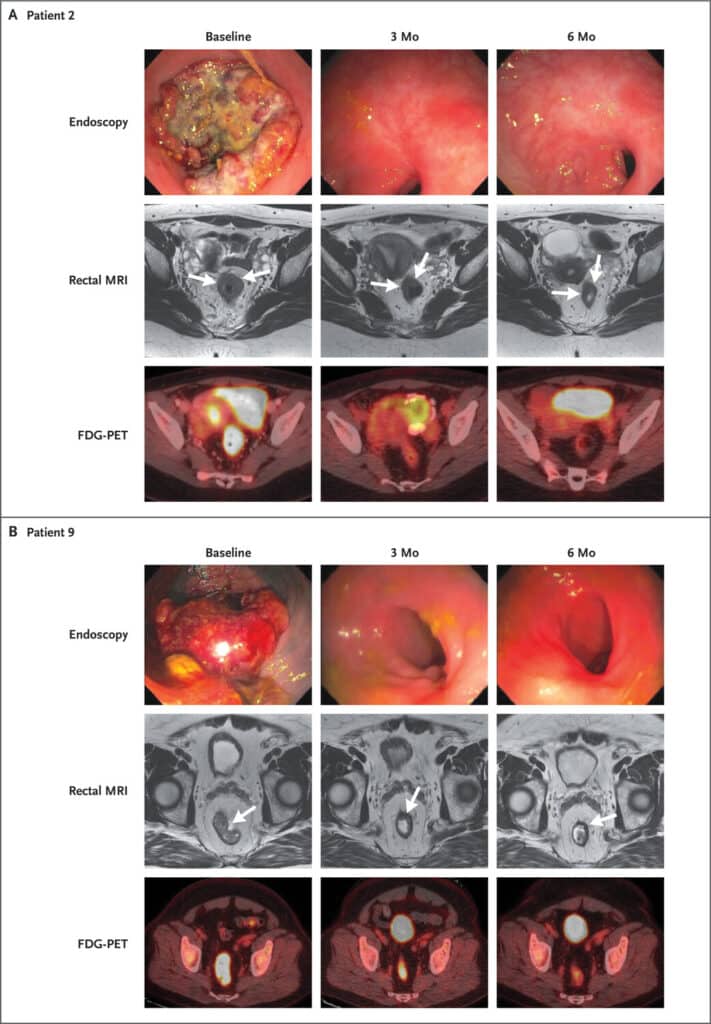


Les résultats des évaluations endoscopiques, de l’IRM pondérée en T2 du rectum et de la tomographie par émission de positons au 18 F-fluorodésoxyglucose (FDG-PET) sont présentés pour deux patients représentatifs au départ et à 3 mois et 6 mois. Le tableau A (patient 2) montre une réponse complète endoscopique et une réponse presque complète sur l’IRM rectale pondérée en T2 à 3 mois ainsi qu’une réponse clinique complète à 6 mois. Le tableau B (patient 9) montre une réponse complète endoscopique et une réponse complète radiographique à 3 mois. Les flèches identifient la tumeur à chaque point temporel. © Cercek et al.
L’obtention du Breakthrough Therapy Designation permettra d’accélérer considérablement les procédures vers la commercialisation du traitement. Cette désignation est uniquement destinée aux nouveaux médicaments ciblant les maladies graves pour lesquelles aucun autre traitement comparable n’est disponible.
Cette année, la FDA a reçu 1 516 demandes à cet effet et seules 587 ont été approuvées. GSK prévoit d’effectuer des essais supplémentaires pour le dostarlimab et de poursuivre les suivis pour les patients déjà traités. La thérapie devrait être disponible 3 ans plus rapidement que les médicaments standard, si tout se déroule comme prévu.