Dans l’article précédent, nous avions vu les différentes façons de représenter les molécules. Cela constituait donc le point de départ pour apprendre à nommer les différentes molécules dont notre univers regorge. Nous allons ainsi commencer par voir dans cette seconde partie les principales règles de nomenclature.
1. Règles de nomenclature
Le nom d’un composé organique peut se découper en trois parties :
- Le PREFIXE : Celui-ci sera formé par les substituants ou les groupes fonctionnels secondaires. Une substitution se caractérise par la réaction dans laquelle un atome (ou groupe d’atomes) en remplace un autre (ou un autre groupe d’atomes) sur un site dans une molécule. Un groupe fonctionnel est, quant à lui, un atome ou groupe d’atomes possédant, à chaque fois qu’on le retrouve dans des molécules différentes, des propriétés physico-chimiques similaires.
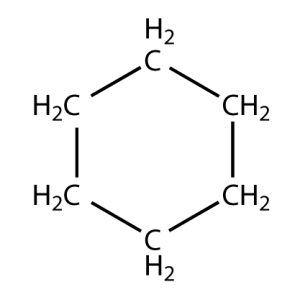
- La RACINE : Celle-ci est formée par la structure fondamentale de la molécule. Elle est la racine du nom. C’est elle que l’on dénomme avant l’addition des préfixes et/ou du suffixe caractérisant les groupes fonctionnels (dont nous verrons les appellations dans le tableau de la partie suivante). Celle-ci peut être acyclique ou cyclique : on distingue les molécules acycliques à chaînes linéaires ou ramifiées, comme celle-ci :


Source Par définition, celle-ci a sa chaîne carbonée refermée sur elle-même. Pour qu’une molécule soit définie comme cyclique, la totalité ou au moins une partie de la chaîne carbonée doit former un cycle.
La racine peut aussi être saturée ou non. Le nombre d’insaturations d’une molécule est le nombre de cycles ou de liaisons multiples qu’elle comporte (double ou triple liaison). Une insaturation correspond donc à un défaut de deux atomes d’hydrogène par rapport au composé saturé correspondant.
- Le SUFFIXE : Celui-ci est composé du groupe fonctionnel principal et/ou des insaturations.

2. Tableau des suffixes et préfixes des groupes fonctionnels principaux, par ordre de priorité
Dans le tableau ci-dessous, nous allons voir les préfixes et suffixes des groupes fonctionnels principaux afin de pouvoir les nommer, qu’ils soient secondaires ou principaux.
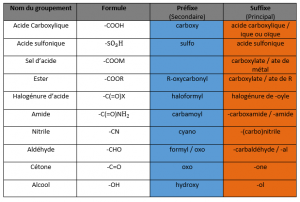
Ce tableau n’est pas exhaustif, mais il contient les groupements principaux dont nous aurons besoin dans notre apprentissage du langage des molécules. Lorsque l’on retrouve la lettre « X » dans le tableau (comme par exemple dans la ligne des halogénures d’acide) cela désigne un halogène (cf article précédent). Et pour la lettre « R », cela désigne un groupement alkyle, c’est-à-dire un groupement composé de carbone et d’hydrogène.
3. Nomenclature des hydrocarbures saturés acycliques
Un hydrocarbure est un composé ne contenant que des atomes de carbone et des atomes d’hydrogène. Son nom générique est l’alcane, dérivé de l’alkyle comme vu précédemment. Le groupe alkyle (ou radical alkyle) est la structure obtenue lorsqu’on enlève un atome d’hydrogène à un alcane.
Vous trouverez ci-dessous les alcanes à chaîne normale et les radicaux qui en sont dérivés :

À la 4ème ligne du tableau, la lettre « n » précédent le nom de l’alcane indique qu’il s’agit d’une chaîne non ramifiée (n pour normal).
La terminaison « -ane » est précédée d’un préfixe numérique indiquant le nombre d’atomes de carbone de la chaîne carbonée. Cette numérotation se fait à partir de la numérotation grecque : pent-, hex-, hept-, etc.
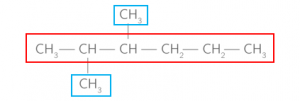
Pour les alcanes ramifiés, on choisit la chaîne carbonée la plus longue. Elle constitue le squelette de la molécule. Ensuite, on numérote les carbones de cette chaîne à partir d’une extrémité de sorte que la somme des indices des substituants soit minimale.
Exemple :
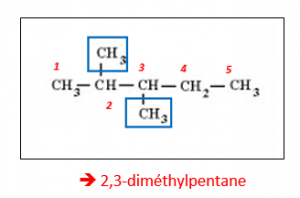
Dans les encadrés bleus, nous avons les deux substituants « méthyle », et en rouge la numérotation du squelette de carbone de la molécule correspondant à la chaîne la plus longue. Afin que la somme des indices (chiffres en rouge) des substituants soit minimale, on commence à numéroter par la gauche. Les deux substituants sont donc en indice deux et trois, on ajoute le « di » avant le nom de l’alcane car il y a bien deux groupements méthyle, et puis on ajoute le préfixe numérique pentane car la chaîne carbonée est composée de cinq carbones.
Voici un premier aperçu du mécanisme de nommage des molécules. Nous nous retrouverons dans un prochain article à venir pour approfondir le langage des molécules organique qui forment notre univers. Bientôt, elles n’auront plus de secrets pour vous !