Après la maladie d’Alzheimer, la maladie de Parkinson est la deuxième maladie neurodégénérative la plus fréquente en France. Elle se manifeste par la dégénérescence progressive des neurones à dopamine dans la substance noire du cerveau. Il n’existe à ce jour aucune cure contre cette maladie. Une nouvelle étude s’avère néanmoins très prometteuse : des chercheurs ont identifié une protéine jouant un rôle majeur dans la neurodégénérescence, pouvant potentiellement être inhibée pour protéger les cellules clés de la fonction motrice. Il ralentit son évolution.
La maladie de Parkinson touche plus de 10 millions de personnes dans le monde. Elle apparaît généralement autour de 70 ans ; elle entraîne peu à peu des symptômes moteurs (akinésie, hypertonie et tremblements) et aussi non moteurs (troubles cognitifs, anosmie, problèmes de sommeil, etc.). Les traitements actuels permettent de contrôler les symptômes moteurs de la maladie, mais ne parviennent pas à inverser, ou même à traiter, les dommages neurologiques sous-jacents.
De nombreuses recherches se concentrent sur les moyens de préserver les neurones producteurs de dopamine, qui sont impliqués dans la fonction motrice. Des scientifiques de la Medical University of South Carolina se sont ainsi focalisés sur les gènes qui peuvent empêcher leur destruction ; plus précisément, ils se sont intéressés à une paire de protéines, Nrf2 et Bach1, capables de contrôler l’activité de ces gènes. Leurs recherches vont être publiées dans la revue Proceedings of the National Academy of Sciences.
Une protéine qui favorise l’inflammation
Nrf2 est un facteur de transcription qui active l’expression de plus de 250 gènes associés à la protection des neurones contre l’inflammation et le stress oxydatif toxique. À l’inverse, Bach1 est une protéine qui empêche l’activation de ces gènes. Or, l’analyse post-mortem du cerveau de patients atteints de la maladie de Parkinson, a montré des niveaux élevés de Bach1 ; les cellules dénuées de cette protéine étaient en revanche protégées des dommages. Le même phénomène a été observé dans des modèles précliniques de la maladie. Il était donc clair que des niveaux élevés de Bach1 contribuent à la physiopathologie de la maladie. « C’est la première preuve que Bach1 est dérégulé dans la maladie de Parkinson », souligne Bobby Thomas, qui a dirigé l’étude.
Pour confirmer leur hypothèse, les chercheurs ont travaillé sur des modèles murins de la maladie, dans lesquels ils ont éliminé la protéine Bach1 ; ils ont alors constaté que les neurones producteurs de dopamine étaient protégés de certains facteurs de stress à l’origine de la dégénérescence. Pour déterminer comment l’absence de cette protéine protégeait les neurones du stress oxydatif, ils ont entrepris d’analyser l’intégralité du génome du cerveau des souris dépourvues de Bach1 pour identifier quels gènes étaient activés.
C’est ainsi qu’ils ont découvert que Bach1 inhibait l’expression des gènes protecteurs contrôlés par la protéine Nrf2, mais qu’il régulait aussi l’expression de nombreux autres gènes qui n’étaient pas associés à Nrf2. « Il y a donc des avantages supplémentaires à inhiber Bach1 en plus de simplement activer Nrf2 », conclut Thomas. En d’autres termes, il serait souhaitable de disposer d’un médicament capable d’inhiber Bach1 tout en activant Nrf2.
Une approche potentielle pour d’autres maladies neurodégénératives
En collaboration avec la société vTv Therapeutics, l’équipe de Thomas a donc travaillé à la mise au point d’un inhibiteur de Bach1. Parmi les quelques candidats potentiels, une substance dénommée HPPE s’est avérée particulièrement efficace dans des modèles in vitro ; et cet inhibiteur s’est révélé être également un puissant activateur de Nrf2.
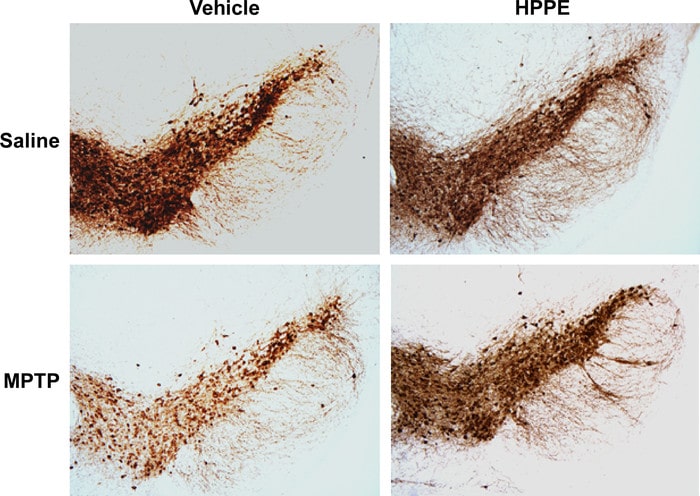


L’HPPE a alors été testé sur des modèles murins de la maladie (provoquée par injection de neurotoxines) : les chercheurs ont constaté qu’il était capable de protéger les cellules de l’inflammation et de l’accumulation de stress oxydatif toxique et ce, qu’il soit administré avant ou après l’apparition des symptômes de la maladie. D’autres analyses ont montré que l’HPPE protège les neurones des voies destructrices en activant les gènes antioxydants et en désactivant les gènes pro-inflammatoires.
D’après l’équipe, l’efficacité de ce nouveau médicament surpasse les activateurs Nrft2 existants à l’heure actuelle — tels que le fumarate de diméthyle (Tecfidera), utilisé dans le traitement de la sclérose en plaques. Les activateurs actuels fonctionnent comme des électrophiles — ils se lient et modifient en permanence les protéines, ce qui peut entraîner une toxicité cellulaire ou une activation du système immunitaire — et ont par conséquent de nombreux effets secondaires. Ce qui n’est pas le cas de l’HPPE : « En raison de cette différence, espérons-le, HPPE ne démontrera pas autant d’effets secondaires », ajoute Thomas.
Les chercheurs envisagent d’explorer cette nouvelle piste dans d’autres études, et prévoient d’examiner en particulier les impacts que peut avoir une utilisation à long terme de l’HPPE. Ils notent par ailleurs qu’il pourrait potentiellement contribuer à lutter contre d’autres maladies neurodégénératives. « Cette voie peut être bénéfique chaque fois que vous avez des déficiences dans les voies anti-inflammatoires ou des dysfonctionnements mitochondriaux », conclut le chercheur.


