La longévité des cétacés bat parfois des records : certaines espèces de baleines atteignent l’âge de 200 ans. Pour les scientifiques, il est tout bonnement incroyable que des organismes aussi grands vivent aussi longtemps. En effet, leur taille signifie que leur corps contient beaucoup plus de cellules que le corps humain, ce qui implique un risque bien plus élevé que l’une de ces cellules devienne cancéreuse. Et pourtant, les cétacés affichent des taux de cancer beaucoup plus faibles que la plupart des mammifères, dont les humains.
Ce phénomène est connu sous le nom de « paradoxe de Peto », du nom du statisticien et épidémiologiste anglais, Richard Peto, qui a constaté que l’incidence du cancer n’est pas nécessairement en corrélation avec le nombre de cellules d’un organisme. « Il y a une blague selon laquelle les baleines devraient naître avec un cancer et ne même pas pouvoir exister parce qu’elles sont tout simplement trop grosses », plaisante Vincent Lynch de l’Université de Buffalo à New York. Le biologiste explique que ces animaux ont simplement mis au point de meilleurs mécanismes de protection contre le cancer.
Une équipe de chercheurs s’est intéressée à ce phénomène, afin de comprendre comment les cétacés parviennent à éviter l’apparition de cancers. Ils ont ainsi étudié le rôle de la sélection naturelle dans l’évolution de plus de mille gènes suppresseurs de tumeurs chez ces espèces. Les résultats de ces recherches pourraient potentiellement constituer une nouvelle piste dans la prévention et le traitement des cancers humains.
Un taux de renouvellement de gènes exceptionnel
On retrouve les mêmes types de cancers chez tous les mammifères et les mécanismes qui conduisent à leur développement sont très similaires. Pourtant, certains organismes atteignent des tailles corporelles plus grandes et/ou une longévité accrue, ce qui intrigue les scientifiques depuis des décennies. Les cétacés ont évolué à partir d’un ancêtre terrestre et sont entrés dans les océans il y a 50 millions d’années. Leur adaptation à un mode de vie aquatique a nécessité de nombreux changements morphologiques, physiologiques et comportementaux. Le sous-ordre des cétacés comprend deux lignées principales : les baleines à dents et les baleines à fanons, qui présentent une grande variation en termes de masse corporelle (de 50 kg à 175 tonnes) et de durée de vie (de 17 à 211 ans).
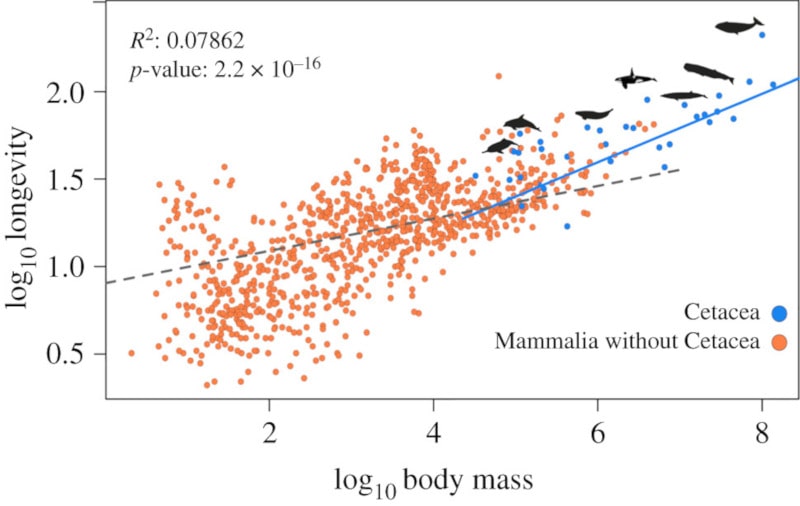
Parce qu’il existe des espèces qui vivent plus de cent ans, elles sont exposées pendant une période beaucoup plus longue à l’apparition de mutations nuisibles, d’agents pathogènes ou de maladies. Ainsi, les cétacés ont probablement développé des améliorations de leur système immunitaire, des mécanismes de réparation de l’ADN et d’autres processus biologiques qui pourraient favoriser une plus grande longévité et une plus grande masse corporelle.
Daniela Tejada-Martinez et ses collègues ont comparé l’évolution de 1077 gènes suppresseurs de tumeurs (GST) chez 15 espèces de mammifères, dont sept espèces de cétacés. Leurs analyses ont révélé que le taux de renouvellement de ces GST — soit la vitesse à laquelle ils ont été gagnés ou perdus par mutation — était près de 2,4 fois plus élevé que chez la plupart des autres mammifères ; ce taux était particulièrement élevé chez les baleines à fanons. L’équipe a également constaté que plusieurs gènes clés ont fait l’objet d’une sélection positive parmi les cétacés.
Des mécanismes anticancéreux supplémentaires
Plus précisément, ils ont découvert un signal de sélection positive chez l’ancêtre des cétacés sur le gène CXCR2, ainsi que dans les gènes DAB2, ADAMTS8, DSC3, EPHA2, TMPRSS11A, ANXA1 de l’ancêtre des baleines à fanons. Or, selon The Human Gene Database, ces gènes avec la signature d’une sélection positive sont impliqués dans de multiples formes de cancer, telles que le néoplasme pulmonaire (ADAMTS8), la leucémie (ANXA1) et le tératocarcinome (DAB2), ainsi que dans les troubles du système immunitaire tels que le syndrome de neutropénie congénitale (CXCR2).
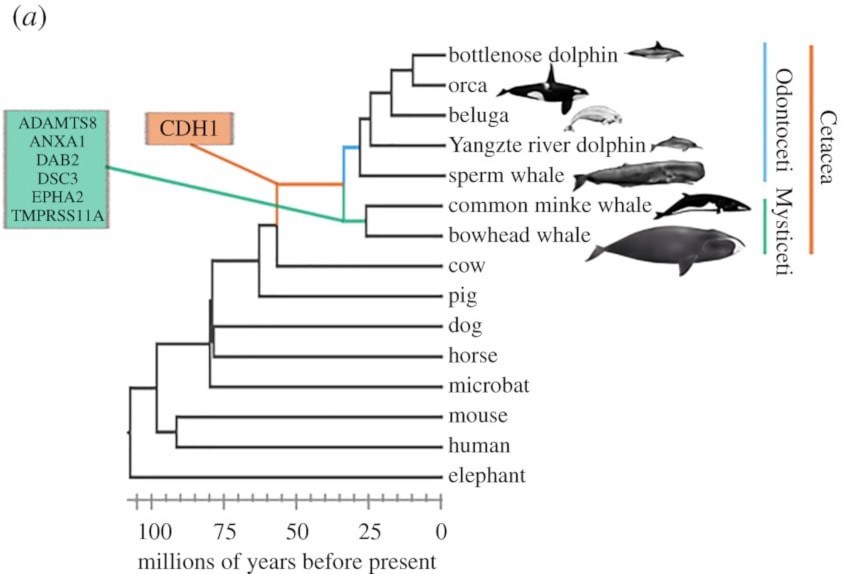
En résumé, le génome des cétacés affiche des signatures de sélection positive sur plusieurs gènes impliqués dans plusieurs types de cancer ou dans des troubles de l’immunité, ce qui devrait augmenter leur prédisposition au cancer. Par conséquent, les chercheurs estiment que ces animaux, notamment les baleines à fanons, ont pu évoluer en développant des mécanismes anticancéreux et/ou antivieillissement supplémentaires, réduisant ainsi le risque de cancer et favorisant la longévité et une plus grande masse corporelle. Ce qui pourrait notamment expliquer leur taux élevé de renouvellement des GST.
Ils déclarent par ailleurs avoir identifié 71 gènes ayant été dupliqués dans une ou plusieurs espèces de cétacés, dont 11 sont liés à la longévité et sont des régulateurs importants de la sénescence (vieillissement cellulaire), tels que les gènes NOTCH3, IGFBP3 et SIK1. « Dans l’ensemble, cette étude fournit des preuves évolutives que la sélection naturelle parmi les GST pourrait agir favorablement pour les espèces de grande taille corporelle et à durée de vie prolongée, fournissant de nouvelles informations sur la base génétique associée à l’évolution de la résistance aux maladies », concluent les auteurs de l’étude.
La découverte est importante, car ces résultats pourraient être utilisés pour créer des gènes suppresseurs de tumeurs chez des organismes plus petits, tels que les humains. Les chercheurs se penchent déjà sur ce type d’étude. « Il serait intéressant d’étudier l’effet de ces variantes de GST chez les baleines dans les cellules humaines. Une telle piste d’investigation pourrait éventuellement conduire à une compréhension de nouvelles voies visant à améliorer les mécanismes cellulaires protégeant contre les dommages à l’ADN, le cancer et le vieillissement », ont écrit les auteurs de l’étude.
« Ce n’est pas comme si nous allions prendre des gènes de baleine et les introduire chez les humains pour les rendre résistants au cancer », dit Vincent Lynch. Le spécialiste explique que s’il est possible de trouver les gènes qui jouent un rôle dans la suppression des tumeurs chez d’autres animaux, et si l’on comprend pleinement leur mode d’action, il pourrait alors être possible de développer un médicament qui imite cette action pour traiter les cancers de l’Homme.



