En France, comme dans d’autres pays développés, les maladies génétiques et malformations congénitales sont la deuxième cause la plus fréquente de décès chez l’enfant. Leur prévalence est de plus de 40 naissances sur 1000. Dans ce qui est considéré que comme une avancée très prometteuse, des chercheurs de l’Institut du génome de Singapour (GIS) ont mis au point un éditeur de gènes basé sur la technologie CRISPR permettant de corriger les mutations à l’origine de maladies génétiques.
Il y a de fortes chances que vous ou quelqu’un de votre entourage fasse partie des quelque 450 millions de personnes touchées par une maladie génétique dans le monde. Les mutations responsables de ces troubles peuvent être causées par de multiples mutagènes — de la lumière du soleil aux erreurs spontanées dans les cellules.
La mutation la plus courante est la substitution monobase, dans laquelle une base unique de l’ADN (telle que G) est remplacée par une autre base (telle que C). Dans le monde, d’innombrables patients atteints de mucoviscidose ont la base C à la place de la G, ce qui engendre des protéines défectueuses à l’origine de la maladie génétique. Dans un autre cas, le remplacement de la base A par la base T dans l’hémoglobine (une protéine des globules rouges) provoque la drépanocytose (ou anémie falciforme). Ce ne sont là que quelques exemples.
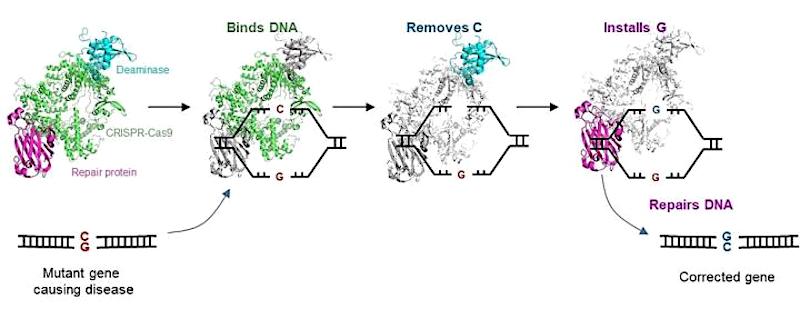
Pour corriger ces substitutions, les chercheurs ont mis au point un éditeur de gènes basé sur CRISPR, qui remplace précisément le C défectueux du génome par le G souhaité. Cet éditeur CGBE ouvre la voie à des options de traitement pour environ 40% des substitutions de base uniques associées à des maladies humaines telles que la mucoviscidose, certaines maladies cardiovasculaires, musculo-squelettiques et certains troubles neurologiques. Ils ont nommé leur éditeur « C-to-G Base Editor (CGBE) ». Les détails de fonctionnement ont été publiés dans la revue Nature Communications. « Nous ciblons en outre des gènes liés à la dyslipidémie, à la cardiomyopathie hypertrophique et à la surdité », écrivent les chercheurs dans le document.
CRISPR-Cas9 : une technique d’édition qui tient ses promesses
L’éditeur CGBE utilise la technologie CRISPR-Cas9, largement adoptée, pour permettre en quelque sorte la « chirurgie moléculaire » du génome humain. CRISPR-Cas9 est couramment utilisée pour perturber des gènes cibles, mais elle est inefficace lorsqu’une modification précise de séquences particulières est souhaitée. L’éditeur CGBE résout un aspect essentiel de ce défi en permettant des modifications génétiques efficaces et précises, avec l’aide de CRISPR.
Le CGBE se compose de trois parties : 1) un CRISPR-Cas9 modifié repère le gène mutant et concentre l’ensemble de l’éditeur sur ce gène ; 2) une désaminase (enzyme qui supprime le groupe amino d’un composé) cible ensuite le C défectueux et le marque pour qu’il soit remplacé ; 3) enfin, une protéine déclenche des mécanismes cellulaires pour remplacer le C défectueux par un G. Cela permet une conversion directe de C en G, jusqu’alors impossible, qui corrige la mutation et, par conséquent, traite le trouble génétique.
« L’éditeur de gènes CGBE est une invention révolutionnaire qui, pour la première fois, convertit directement le C en G dans les gènes, ce qui ouvre potentiellement des perspectives de traitement pour une fraction substantielle des troubles génétiques associés à des mutations mononucléotidiques », déclare le Dr Chew Wei Leong, chercheur principal au GIS.
« La sécurité des patients est essentielle », souligne Chew. « Nous nous efforçons de garantir que nos modalités CGBE et CRISPR-Cas sont à la fois efficaces et sûres dans les modèles de maladie avant de pouvoir poursuivre le développement de ces modalités pour les essais cliniques ».
« De nouveaux éditeurs tels que CGBE viennent élargir la gamme croissante d’outils d’édition précise du génome, qui comprend les éditeurs de bases cytidine (CBE), les éditeurs de bases adénine (ABE) et les éditeurs primaires. Ensemble, ils permettent l’ingénierie précise et efficace de l’ADN pour la recherche, l’enquête biologique et la correction des maladies, ouvrant ainsi la voie à une nouvelle ère de la médecine génétique », a déclaré le professeur Patrick Tan, directeur général du GIS.