La diminution d’une protéine spécifique au niveau de cellules endothéliales tapissant la barrière hématoencéphalique pourrait jouer un rôle clé dans la progression de certaines maladies neurodégénératives, dont Alzheimer et la sclérose latérale amyotrophique (SLA), révèle une étude. Alors qu’on pensait initialement que les altérations vasculaires étaient des dommages collatéraux de ces maladies, l’étude met en lumière une voie moléculaire spécifique aux cellules vasculaires jusqu’à présent non identifiée.
La barrière hémato-encéphalique (BHE) joue un rôle de régulateur naturel des molécules et des cellules pouvant infiltrer ou non le système nerveux central. Les jonctions serrées et les protéines adaptatrices des cellules endothéliales tapissant la barrière assurent une fonction de filtrage hautement sélectif. Il a été démontré que l’altération de la BHE joue un rôle dans la neurodégénérescence associée au vieillissement.
En particulier, des études ont montré que le dysfonctionnement de la BHE est plus marqué et progresse bien plus rapidement chez les patients souffrant de maladies neurodégénératives, telles qu’Alzheimer. Des données d’imagerie ont également montré des changements au niveau de la BHE qui précèdent l’apparition des marqueurs classiques d’Alzheimer et de l’atrophie cérébrale. Ces perturbations ont également été observées dans d’autres maladies neurodégénératives, telles que la SLA et la démence frontotemporale (DFT).
Les chercheurs soupçonnent que l’implication de l’altération de la BHE dans la neurodégénérescence pourrait découler des cellules endothéliales qui la composent. En effet, bien que différents types de cellules contribuent à sa fonction, les cellules endothéliales constituent ses principales composantes.
Cependant, l’implication de ces cellules demeurait jusqu’à présent incertaine, principalement parce qu’elles sont difficiles à isoler des tissus, ce qui complique l’identification des voies moléculaires potentiellement associées à la neurodégénérescence. « On dit souvent dans le domaine que ‘nous n’avons que l’âge de nos artères’. Dans toutes les maladies, nous apprenons l’importance de l’endothélium. Je n’avais aucun doute qu’il en serait de même pour la neurodégénérescence, mais observer le fonctionnement de ces cellules était une première étape très importante », explique dans un article de blog Omar Moustafa Fathy Omar, de l’École de médecine de l’Université du Connecticut.
Dans le cadre d’une nouvelle étude récemment publiée dans la revue Nature Neuroscience, Omar et ses collègues ont développé une approche permettant d’observer en détail les interactions protéiniques à l’intérieur des cellules endothéliales de la BHE. Leurs résultats suggèrent que ces cellules sont bien plus actives qu’on le pensait dans l’étiologie de la neurodégénérescence. « Il est facile de considérer les vaisseaux sanguins comme des conduits passifs, mais nos résultats remettent en question cette vision », indique Fathy.
Un sous-ensemble de cellules spécifiques à la neurodégénérescence
Pour effectuer leurs analyses, Omar et ses collègues ont prélevé des échantillons post-mortem de cellules endothéliales et des cellules microgliales provenant des cortex de patients stockés dans une biobanque financée par la National Institutes of Health (NIH). Ces échantillons provenaient de 92 donneurs âgés de 20 à 98 ans (50 hommes et 42 femmes), dont certains étaient atteints de SLA, d’Alzheimer ou de DFT.
Les chercheurs ont utilisé une technique de séquençage de pointe appelée inCITE-seq, permettant de mesurer directement les réponses de signalisation protéique dans les cellules individuelles. Il s’agit de la première fois que la technique est utilisée avec des tissus humains.
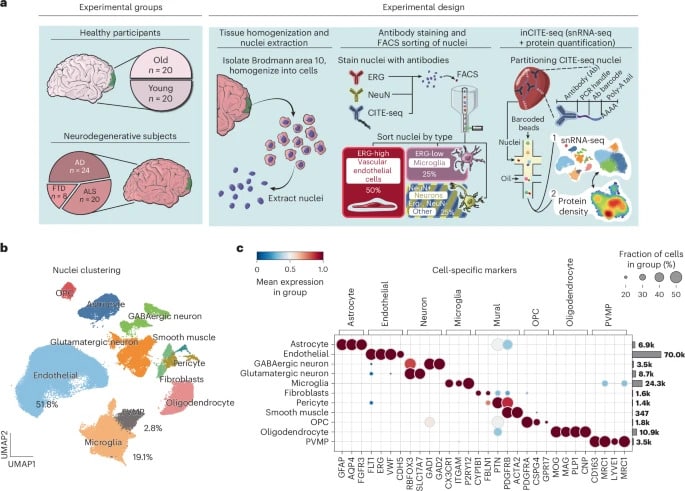
L’équipe a constaté que les cellules endothéliales des patients atteints d’une des trois maladies neurodégénératives présentaient des similitudes frappantes les distinguant de celles caractérisant le vieillissement en bonne santé. Les chercheurs ont identifié un sous-ensemble de cellules capillaires spécifiquement associé à la neurodégénérescence.
Ces cellules présentaient une baisse marquée de l’expression de la protéine TDP-43, une protéine de liaison à l’ARN couramment associée à la SLA et la DFT et fréquemment altérée chez les patients Alzheimer. Cependant, les précédentes observations se concentraient uniquement sur les neurones, et ces nouveaux résultats suggèrent un dysfonctionnement jusqu’à présent méconnu des cellules endothéliales.
« Dans de nombreuses maladies neurodégénératives, nous observons des modifications vasculaires étonnamment similaires, ce qui suggère que la vascularisation n’est pas seulement un dommage collatéral : elle influence activement la progression de la maladie », explique Fathy. « La reconnaissance de ces points communs ouvre la voie à de nouvelles possibilités thérapeutiques ciblant la vascularisation elle-même », suggère-t-il.
Les experts estiment en outre que le sous-ensemble de cellules endothéliales identifié pourrait potentiellement conduire à des stratégies permettant de prévenir la neurodégénérescence. Ces résultats pourraient aussi permettre d’identifier de nouveaux biomarqueurs sanguins offrant peut-être la possibilité de diagnostiquer les maladies à un stade précoce.