En France, plus de 500 patients meurent chaque année faute d’avoir pu bénéficier d’une greffe d’organe. Depuis des années, les scientifiques tentent de reproduire des organes humains ex vivo pour pallier la pénurie d’organes, qui constitue aujourd’hui un véritable problème de santé publique. Les derniers travaux du professeur Jacob Hanna, du Weizmann Institute of Science, apportent aujourd’hui un nouvel espoir pour le développement de la culture d’organes à des fins de transplantation.
Jacob Hanna et son équipe ont trouvé un moyen de cultiver des cellules souches humaines à un stade beaucoup plus précoce que ce qui était possible auparavant. Ces cellules présentent l’avantage d’être dans un état complètement indifférencié (on parle également d’état « naïf »), ce qui signifie qu’elles peuvent potentiellement se développer en n’importe quel type de cellule. En outre, ces cellules ont la capacité de mieux s’intégrer à l’organisme hôte, et ce, même si cet organisme receveur n’est pas de la même espèce !
En moyenne, seuls 1 à 3% des cellules transférées d’une espèce à l’autre parviennent à s’intégrer pleinement à l’hôte et à contribuer à son bon développement. Mais la technique proposée par Hanna et ses collègues offrent de meilleurs résultats. « L’amélioration de notre capacité à créer et à étudier ces types de cellules pourrait être utilisée à l’avenir pour transférer des cellules – voire des organes – d’un animal à un autre, y compris l’homme », soulignent les chercheurs dans un communiqué.
Des cellules à la fois compétentes et compétitives
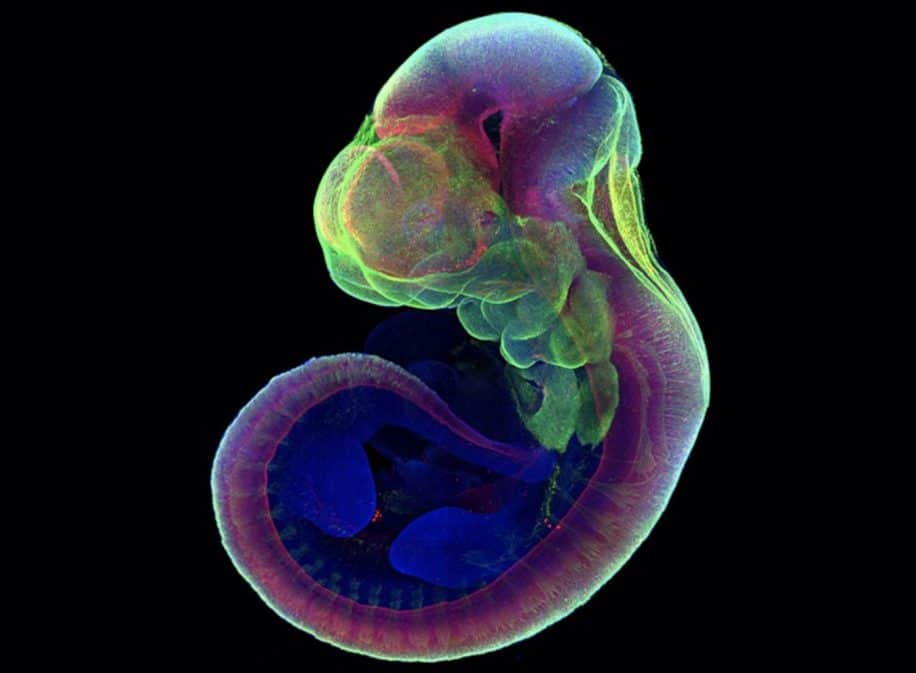
En 2013, l’équipe avait été la première au monde à injecter des cellules souches humaines dans des souris, dans le but de montrer que ces cellules s’intégraient tout à fait aux embryons des rongeurs et participaient même à leur développement. Cette fois-ci, les chercheurs ont entrepris d’aller plus loin dans leur expérimentation en produisant des cellules souches encore plus précoces. La difficulté résidait néanmoins dans le fait que ces cellules souches entièrement naïves sont relativement instables génétiquement parlant ; elles ne se différencient généralement pas très bien et de ce fait, compromettent le développement embryonnaire.
Pour augmenter leurs chances de réussite, l’équipe a inhibé plusieurs voies de signalisation pour produire des cellules souches humaines naïves : celles-ci concernent la protéine WNT (qui joue un rôle dans l’embryogenèse), la protéine kinase C (PKC) et la kinase SRC. L’inhibition de ces protéines a permis de consolider l’induction de la pluripotence humaine naïve, avec la capacité de se différencier en cellules souches trophoblastiques (qui sont à l’origine du placenta) et en cellules endodermiques naïves extra-embryonnaires in vitro, rapportent les chercheurs.
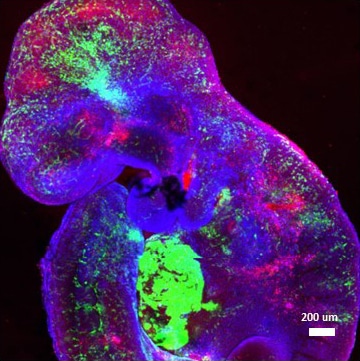
Les chercheurs ont également modifié un gène important, contribuant à la stabilité du génome, ce qui a permis de générer des cellules souches non seulement capables de bien se différencier, mais aussi capables de bien s’intégrer à l’hôte, sans causer de dommages. Cette approche leur a permis de multiplier par cinq environ les chances de réussite d’un transfert de cellules interespèce par rapport aux techniques existantes.
L’étude menée en 2013 avait montré que les cellules souches naïves humaines peuvent se différencier en cellules germinales primordiales — une population cellulaire apparaissant très tôt au cours du développement embryonnaire, d’où sont issus les gamètes (ovules et spermatozoïdes). Dans le cadre de cette nouvelle étude, les cellules souches complètement naïves peuvent également se différencier en cellules de tissus extra-embryonnaires, telles que celles du placenta ou du sac vitellin (qui héberge l’embryon). Ces cellules pourraient ainsi être utilisées comme source pour développer des embryons synthétiques, notent les chercheurs.
Vers une meilleure compréhension du développement embryonnaire
Cette expérience a permis de mettre en évidence certaines différences fondamentales entre les cellules souches humaines et les cellules souches de souris, car atteindre un tel état avec ces dernières est particulièrement difficile à réaliser, souligne Hanna. « Si, à l’avenir, nous souhaitons cultiver un pancréas chez le porc en vue d’une transplantation humaine, nous devrons tenir compte de ces différences évolutives massives entre les espèces », rappelle le spécialiste. Il y a donc encore beaucoup de recherches à mener avant de développer des organes « à la demande » en laboratoire.
L’usage de ces cellules précoces permet également une meilleure compréhension des différentes phases embryonnaires, ce qui pourrait potentiellement mener à de nouvelles thérapies permettant de corriger les erreurs de développement (telles que le spina bifida par exemple). En mars 2021, l’équipe avait d’ores et déjà rapporté avoir réussi à maintenir des embryons de souris hors de l’utérus pendant 11 jours — ce qui correspond à environ un tiers de leur gestation normale. La même approche appliquée à la croissance d’embryons humains pourrait permettre d’étudier des processus du développement humain jusqu’ici inconnus ; il est en effet difficile d’examiner ce qu’il se passe à l’intérieur de l’utérus sans perturber la croissance de l’embryon…
Les travaux de Hanna et ses collègues représentent donc une avancée majeure dans ce domaine. À noter que, de par les récents progrès réalisés dans le domaine des cellules souches, la Société internationale pour la recherche sur les cellules souches (ISSCR) a publié de nouvelles directives en mai 2021, modifiant la règle stipulant que les embryons humains ne doivent pas être cultivés au-delà du 14e jour après la fécondation : les études impliquant la culture d’embryons humains au-delà de la barre des deux semaines sont désormais considérées au cas par cas et soumises à plusieurs phases d’examen pour déterminer à quel moment les expériences doivent être arrêtées.