Au cours des dernières années, l’édition génétique a fait un important bond en avant, notamment grâce au développement de l’outil CRISPR. Ce dernier permet d’effectuer des coupes précises au sein de séquences génétiques, et d’extraire ou insérer des gènes dans les sites choisis. Jusqu’à maintenant, la méthode ne permettait que de traiter un ou quelques gènes à la fois, limitant ainsi le potentiel d’édition génétique. Mais récemment, des chercheurs ont mis au point une nouvelle technique permettant de manipuler des dizaines, voire des centaines de gènes simultanément.
Selon l’équipe, cela pourrait ouvrir toutes sortes de nouvelles possibilités, permettant aux scientifiques de reprogrammer des cellules à plus grande échelle et de manière plus sophistiquée : lors de l’étude de troubles génétiques complexes, par exemple, ou lors de la tentative de remplacement de cellules endommagées par des cellules saines.
Pour la plupart, les techniques CRISPR ne modifient qu’un seul gène à la fois, bien que jusqu’à sept gènes aient été édités ensemble lors de précédentes études. Selon cette dernière recherche publiée dans la revue Nature Methods, la nouvelle technique peut atteindre 25 cibles géniques simultanément, si ce n’est bien plus.
« Notre méthode nous permet, pour la première fois, de modifier systématiquement des réseaux de gènes entiers en une seule étape » explique le biochimiste Randall Platt, de l’ETH Zürich (Suisse). « Grâce à ce nouvel outil, nous, ainsi que d’autres scientifiques, pouvons réaliser ce que nous ne pouvions que rêver par le passé ».
Plasmide et ARN : un ciblage génétique multi-sites
La clé du nouveau système de ciblage multiple est une structure d’ARN stabilisée dans un plasmide, ou molécule d’ADN circulaire, capable de contenir et de gérer des molécules d’ARN supplémentaires. Ces molécules d’ARN agissent comme des marqueurs pour cibler des sites génétiques. Par conséquent, plus le plasmide peut contenir d’ARNs, plus les chercheurs peuvent cibler de sites dans la cellule.
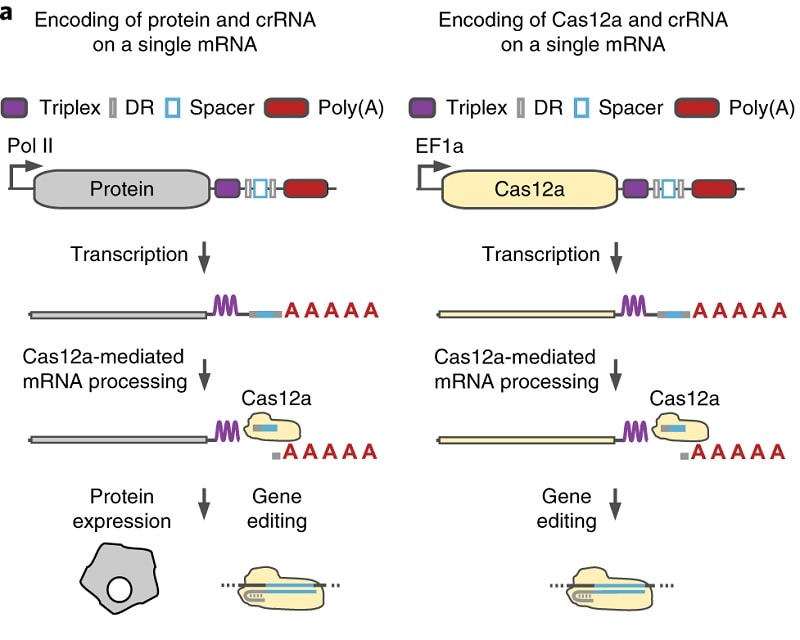
En plus des ARN d’adressage, le plasmide porte une enzyme Cas qui effectue le travail de liaison et de découpage proprement dit. Cas9 est l’enzyme utilisée le plus souvent, mais ici les scientifiques se sont tournés vers Cas12a, une enzyme dont les généticiens ont déjà démontré qu’elle améliorait la précision de l’édition CRISPR. Dans leurs expériences, les chercheurs ont réussi à insérer leur nouveau plasmide dans des cellules humaines en laboratoire.
Une édition génétique fortement optimisée
Ces modifications apportées au processus CRISPR standard pourraient permettre aux scientifiques de procéder à une édition génique plus étendue. Les gènes et les protéines à l’intérieur des cellules interagissent de manière extrêmement complexe.
Parfois, une seule coupe ou un seul changement à la fois peut être limitant. Par exemple, la nouvelle technique pourrait signifier que l’activité de certains gènes peut être augmentée en même temps que l’activité d’autres gènes est réduite — et que toutes ces opérations peuvent également être planifiées avec une plus grande précision.
Sur le même sujet : La technique d’édition de gènes CRISPR permet à présent d’offrir des informations encore plus précises quant à l’activité des cellules



« Les séquences répétées directes et les espaceurs contenant des séquences complémentaires […] pourraient générer des structures d’ARN secondaires complexes affectant la maturation des ARN CRISPR dans les cellules. Par conséquent, des régions complémentaires dans l’ARN pré-CRISPR doivent être considérées pour améliorer la maturation de l’ARN CRISPR. Les travaux futurs visant à surmonter ces limitations ouvriront de nombreuses applications pour l’ingénierie du génome hautement multiplexé » écrivent les auteurs.
« Notre méthode fournit une plate-forme puissante pour étudier et orchestrer les programmes génétiques sophistiqués sous-tendant les comportements de cellules complexes » concluent-ils.



