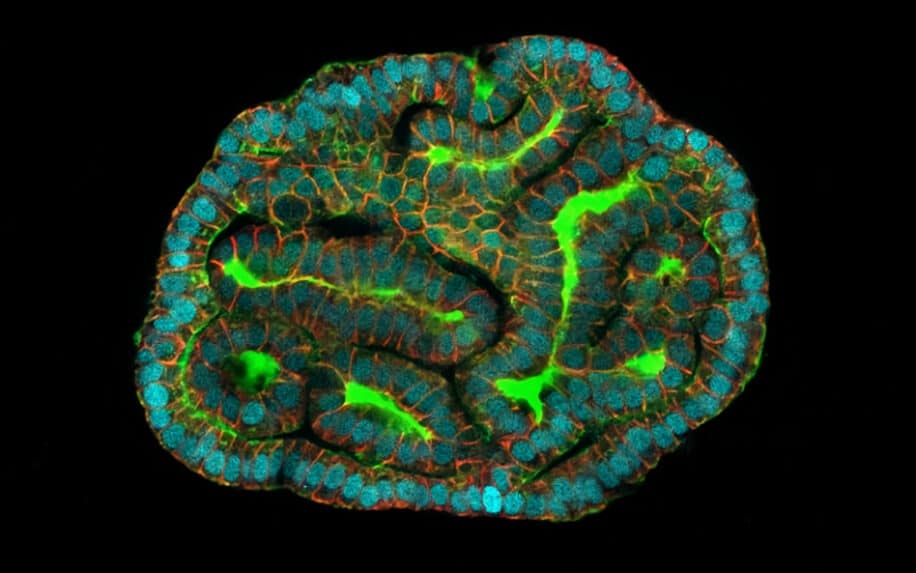
Aujourd’hui, les organoïdes sont à la base d’avancées majeures en médecine et en biologie. Pour la première fois dans l’histoire, des scientifiques ont réussi à cultiver des modèles complexes à partir de cellules du liquide amniotique (le liquide entourant le fœtus dans l’utérus). Le but ? Diagnostiquer les maladies congénitales chez les fœtus et envisager des traitements contre les malformations fœtales. Les chercheurs, de l’University College de Londres et du Great Ormond Street Hospital (Royaume-Uni), entre autres, se disent « enthousiastes » face à cet exploit.
Cultiver des organoïdes humains complexes à partir de cellules du liquide amniotique afin de diagnostiquer les maladies congénitales des fœtus : c’est l’expérience qu’une équipe de chercheurs de Louvain et de Londres a menée. Ils ont publié leurs travaux dans la revue Nature Medicine. Ces organoïdes, comme leur nom l’indique, ne sont donc pas des répliques complètes d’organes, mais en sont suffisamment proches pour réaliser des études sur diverses maladies et différents aspects de la biologie humaine.
Pourquoi avoir choisi le liquide amniotique comme source cellulaire ? Selon les chercheurs, des millions de cellules du fœtus se trouvent dans le liquide amniotique, provenant majoritairement des poumons et des reins. Ainsi, lors d’une échographie, si une anomalie congénitale est révélée, une amniocentèse est effectuée pour mettre en lumière une éventuelle anomalie génétique.
Pour mener à bien cette expérience, les chercheurs, de la KU Leuven, de l’UZ Leuven, de l’University College de Londres et du Great Ormond Street Hospital for Children, ont effectué une amniocentèse chez douze femmes enceintes. C’est de cette manière qu’ils sont parvenus à isoler les cellules souches chargées de la formation des différents organes du fœtus. À partir de ces cellules souches, ils ont réussi à cultiver des organoïdes de poumons, de reins et d’intestins propres à chaque fœtus étudié. Le processus complet a duré environ 4 semaines. D’après le biologiste Mattia Gerli de l’University College, co-auteur de l’étude, « comme la croissance de mini-organes à partir de cellules présentes dans le liquide amniotique prend environ 4 à 6 semaines, cela laisse suffisamment de temps pour qu’une thérapie prénatale corrige les problèmes qui pourraient être détectés par les médecins ».
Vers une première application in utero
Le développement d’organoïdes est possible depuis des années. En revanche, l’étude menée par le Dr Paolo de Coppi et son équipe est une première, car elle implique des cellules de fœtales vivantes. Des organoïdes ont déjà été cultivés à partir de cellules de fœtus avortés, mais cela a posé des problèmes éthiques et des restrictions réglementaires strictes.
« Les organoïdes que nous avons créés à partir de cellules du liquide amniotique présentent de nombreuses fonctions des tissus qu’ils représentent, notamment l’expression des gènes et des protéines », explique Gerli dans un communiqué. « Elles nous permettront d’étudier ce qui se passe au cours du développement, à la fois dans la santé et dans la maladie, ce qui n’était pas possible auparavant », a-t-il affirmé.
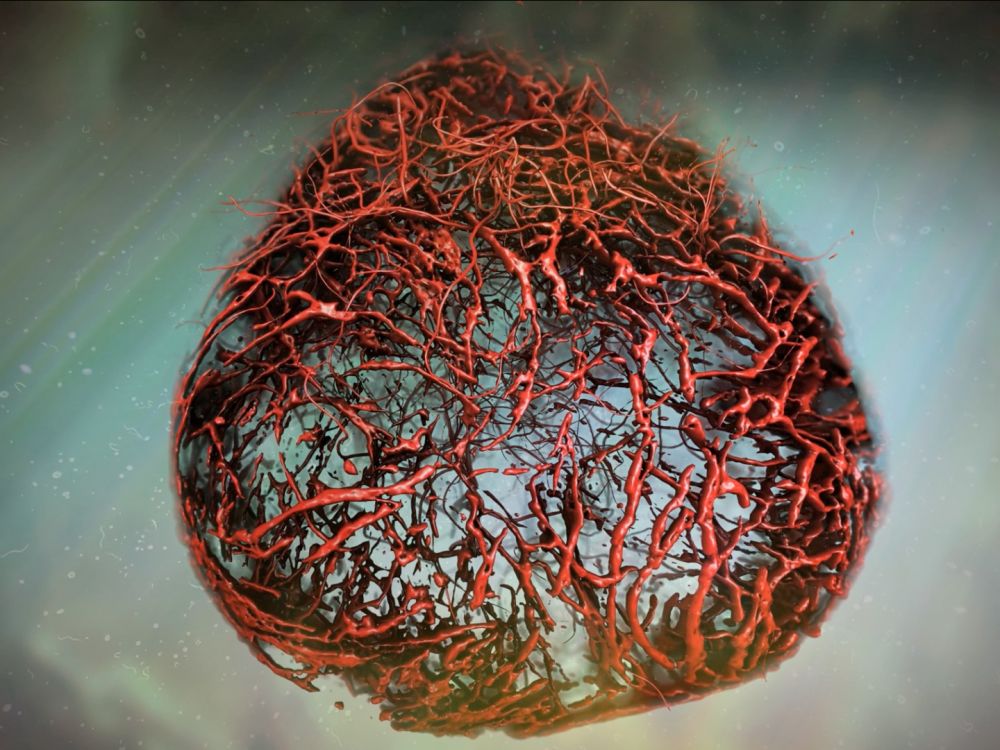
Dans le but d’examiner de plus près l’utilisation pratique de leur approche, l’équipe de recherche s’est intéressée à la hernie diaphragmatique congénitale (HDC). En effet 30 % des fœtus atteints de cette pathologie décèdent. Si les médecins peuvent détecter cette hernie bien avant la naissance du bébé, une opération pourrait être effectuée in utero.
Ainsi, pour mener à bien cette étude, les chercheurs se sont concentrés sur l’analyse d’organoïdes cultivés à partir de fœtus atteints de HDC et les ont ensuite comparés avec des organoïdes de fœtus sains. Par suite, ils sont parvenus à corriger les gènes liés à l’affection, et toujours grâce à cette méthode, ont pu évaluer l’état de santé de l’enfant atteint avant la naissance, selon Dr Paolo. Toujours d’après lui, il s’agit de « la première étape vers un pronostic plus détaillé et des traitements plus efficaces ».
Une lueur d’espoir pour le traitement de la mucoviscidose
« Nous en savons si peu sur la fin de la grossesse humaine qu’il est très excitant d’ouvrir de nouveaux domaines de la médecine prénatale », déclare Gerli. L’élaboration d’un traitement contre la HDC in utero n’est que le début d’un projet de grande envergure. Pour ces chercheurs, les médicaments que cette méthode permettra de développer pour les maladies congénitales, comme la mucoviscidose, pourraient d’ici peu être testés sur des organoïdes. Par la suite, ils pourront être administrés directement aux fœtus, avant que la maladie ne prenne forme.