Des biologistes ont découvert qu’Entamoeba histolytica, une amibe unicellulaire particulièrement résistante, échappe au système immunitaire en grignotant les cellules hôtes et en portant leurs restes comme un déguisement. Cette capacité est due à une fonction génétique qui permet au parasite de contrôler à volonté l’expression de ses gènes. Ces nouvelles données ont ouvert la voie à une stratégie thérapeutique qui pourrait offrir de nouvelles pistes contre le pathogène.
Affectant environ 10 % de la population mondiale, l’amibiase est l’une des infections parasitaires les plus meurtrières. Elle est provoquée par des amibes parasites du genre Entamoeba, dont la plus pathogène est E. histolytica. Les parasites se transmettent par voie oro-fécale et sont présents au stade kystique dans l’eau ou les aliments contaminés. Les amibes actives colonisent le gros intestin, tandis que les kystes et les trophozoïtes sont en partie éliminés dans les selles.
On estime qu’E. histolytica infecte près de 50 millions de personnes chaque année. Si l’infection est asymptomatique ou ne provoque qu’une diarrhée modérée chez certaines personnes, elle peut également ulcérer les parois intestinales et le foie et provoquer des diarrhées hémorragiques potentiellement mortelles. Elle peut également envahir les poumons et le cerveau au stade avancé de la maladie.
Malgré son impact sur la santé humaine, E. histolytica est largement sous-étudié. « Tous les parasites sont sous-étudiés, mais E. histolytica est particulièrement énigmatique », explique Katherine Ralston, professeure agrégée au Département de microbiologie et de génétique moléculaire de l’Université de Californie, à Davis. En conséquence, le mécanisme de base de l’infection est mal compris et les options de traitement sont considérablement limitées.
Non seulement le parasite est particulièrement virulent, mais il semble doté d’une capacité à résister au système immunitaire en s’attaquant directement aux lymphocytes. « Il peut tuer tout ce qu’on lui lance, n’importe quel type de cellule humaine », affirme l’experte. L’équipe de Ralston a comblé les lacunes de compréhension en développant des outils génétiques permettant d’étudier le parasite en profondeur. Cela a permis de proposer une nouvelle stratégie thérapeutique – détaillée dans l’étude publiée dans la revue Trends in Parasitology — qui pourrait potentiellement éradiquer l’infection à la racine.
Une « ruse » génétique pour contourner le système immunitaire
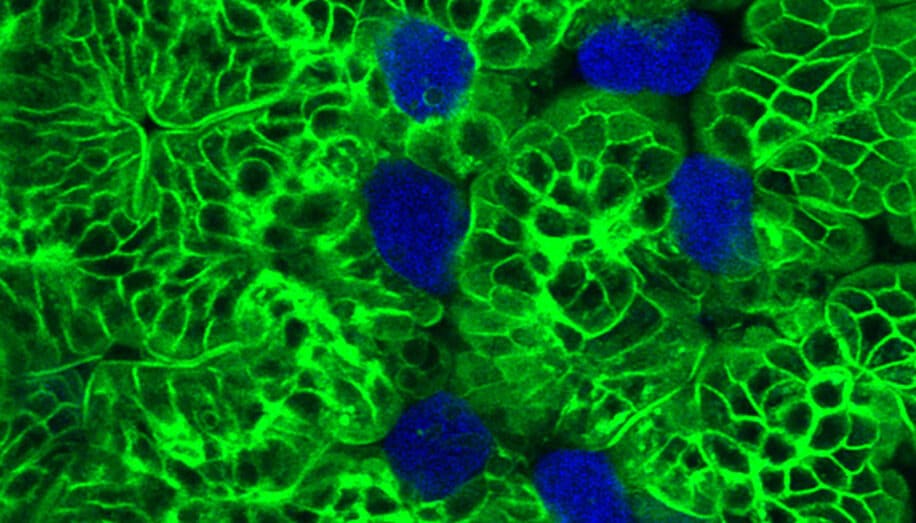
L’appellation histolytica signifie « dissolvant les tissus ». En effet, en pénétrant les tissus, le parasite les liquéfie et crée des poches purulentes d’abcès. En se propageant, il grignote partiellement les cellules et les laissent déverser leur contenu dans le milieu extracellulaire. Les chercheurs pensaient initialement que l’amibe tuait les cellules en y déversant un composé toxique, mais Ralston et ses collègues ont observé un phénomène complètement différent au cours de leurs recherches.
Le parasite mordillait effectivement les cellules hôtes, mais ingérait également de petits fragments de celles-ci avant de s’attaquer à d’autres cellules. Dans une étude publiée en 2022, l’équipe a découvert que ce processus dit « trogocytose » s’explique par le fait que l’amibe devient résistante aux protéines du complément, des composants immunitaires essentiels à la reconnaissance des pathogènes.
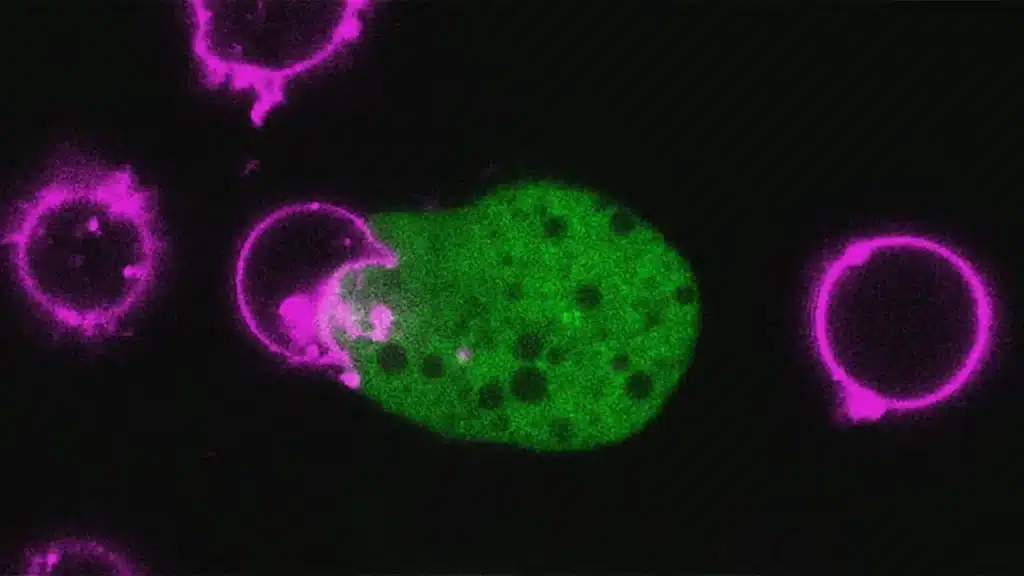
L’amibe acquiert cette résistance en ingérant les protéines membranaires des cellules hôtes et en les portant à sa surface comme des déguisements. Deux de ces protéines hôtes, la CD46 et CD55, permettent de contourner le système immunitaire en empêchant les protéines du complément de se fixer à la surface de l’amibe.
Un processus de contrôle à volonté de l’expression des gènes
Avec des agents pathogènes, tels que le VIH ou la salmonelle, d’importantes avancées ont été réalisées en matière de thérapies en inactivant individuellement les gènes essentiels à leur propagation. Cependant, cela a été difficile pour E. histolytica, car son génome est extrêmement complexe et volumineux. Il est cinq fois plus volumineux que celui de la salmonelle et 2 500 fois plus que celui du VIH. L’analyse génétique des mécanismes sous-tendant sa pathogénicité a donc nécessité des décennies de recherche.
De précédents travaux ont mis en évidence un processus moléculaire appelé « inhibition d’ARN » (ARNi) qui permet au parasite de contrôler à volonté l’expression de ses gènes en fonction de ses besoins. Pour l’analogie, le processus est comparable à un bouton de volume permettant de baisser ou de monter le son à volonté. La caractérisation des ARNi a permis de développer des outils moléculaires pour désactiver sélectivement les gènes du parasite.
Les chercheurs de la nouvelle étude ont développé une bibliothèque d’ARN interférents permettant d’inhiber individuellement l’expression des 8 734 gènes d’E. histolytica. Cela permettrait d’identifier les gènes nécessaires à l’amibe pour la trogocytose et d’autres fonctions essentielles à sa pathogénicité.
Les chercheurs proposent de combiner cette stratégie avec la technique d’édition génétique CRISPR pour marquer les protéines avec des marqueurs fluorescents et observer leurs interactions en détail avant de modifier ou de supprimer des gènes. Cela pourrait aboutir à l’identification de cibles thérapeutiques permettant d’intervenir directement au niveau des fonctions essentielles d’E. histolytica.
« Nous voyons maintenant une lumière au bout du tunnel, et nous pensons que cela [l’identification de cibles thérapeutiques] pourrait être réalisable », conclut Wesley Huang, l’auteur principal de l’étude.