Alors qu’ils effectuaient des recherches sur la croissance des cellules souches du cerveau dans le cadre de la lutte contre les maladies neurodégénératives, des scientifiques ont découvert que ces cellules entraient parfois dans une phase de « sommeil », jamais identifiée jusqu’alors. Ils espèrent à présent exploiter cet état particulier pour stopper la prolifération des cellules cancéreuses.
Les cellules souches du corps humain sont des cellules indifférenciées, capables de s’autorenouveler et de se différencier en d’autres types cellulaires. Toutes les cellules de notre corps, y compris les cellules souches, passent par quatre phases principales : croissance, copie du matériel génétique stocké dans le noyau, nouvelle croissance et division en deux nouvelles cellules. Ces phases sont respectivement appelées G1, S, G2 et M. Sonder les phases du cycle de vie des cellules souches est important pour comprendre et traiter des maladies comme la démence et le cancer.
Après avoir examiné le séquençage d’ARN de cellules souches cérébrales (les cellules neuroépithéliales), des chercheurs en génie biomédical de l’Arizona State University ont découvert une nouvelle phase cellulaire qui n’avait jamais été observée auparavant, baptisée Neural G0. Cette découverte a déclenché un projet de recherche de six ans pour étudier cette nouvelle phase de plus près et déterminer ce que cela implique pour la progression des maladies, en particulier les tumeurs cérébrales.
Mettre les cellules cancéreuses en sommeil
Cette phase Neural G0 nouvellement identifiée plonge les cellules dans une sorte de dormance. Ainsi, les chercheurs tentent de comprendre ce processus pour l’appliquer aux cellules cancéreuses et ainsi mettre en sommeil les tumeurs cérébrales. « La principale caractéristique de tout cancer est que les cellules prolifèrent. Si nous pouvions entrer [dans cette phase] et découvrir quels en sont les mécanismes, ce pourrait être une façon de les ralentir », explique Christopher Plaisier, ingénieur biomédical à l’Arizona State University et co-auteur de l’étude.
Si la plupart des cellules suivent un cycle de vie composé des étapes G1, S, G2 et M, de nombreuses cellules s’arrêtent après leur croissance initiale (G1) et entrent immédiatement dans un état alternatif, nommé G0. Dans cet état, les cellules sont dormantes ou poursuivent leurs fonctions normales sans se préparer à une nouvelle division.
Les cellules souches peuvent elles aussi entrer dans une phase de repos, en dehors de leur cycle (on parle de quiescence cellulaire). L’état Neural G0 est similaire à la quiescence, à la différence qu’il concerne exclusivement les cellules neuroépithéliales, qui sont vouées à devenir des cellules cérébrales ; cet état est caractérisé par une régulation à la hausse des gènes jouant un rôle clé dans le développement neural.
Le cancer survient lorsque les cellules développent des mutations qui les font sortir de l’état G0, puis se développent et se divisent très rapidement. De la même façon, les tumeurs cérébrales ou gliomes, surviennent lorsque les cellules neuroépithéliales entrent dans leur phase de croissance et de division à des taux plus élevés que la normale. Une meilleure compréhension de ces phases de dormance pourrait donc s’avérer cruciale pour lutter contre la prolifération des cellules cancéreuses.
Une approche qui réduirait les risques de récidive
Les scientifiques utilisent des outils spécifiques, des classificateurs, pour attribuer une phase du cycle cellulaire à des cellules individuelles en fonction de l’état des substances de l’ARN messager de la cellule. Mais la plupart de ces classificateurs ne considèrent que les principales étapes du cycle de vie d’une cellule. Plaisier et son équipe ont donc développé un nouvel outil de plus haute résolution, permettant d’analyser plus finement ce qui se passe dans les cycles de croissance des cellules souches.
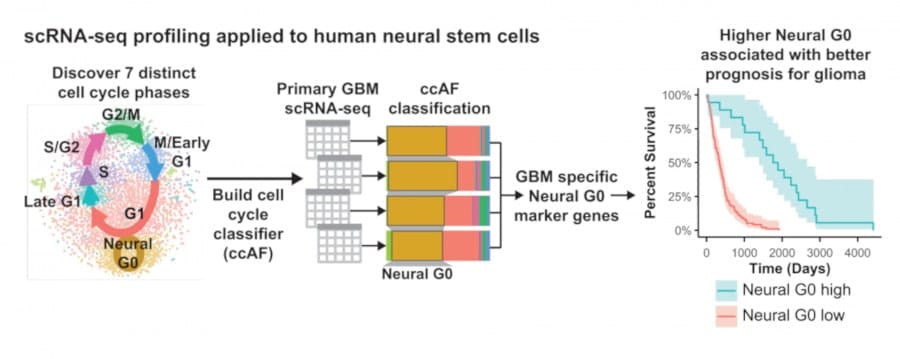
« Notre classificateur pénètre plus profondément dans le cycle cellulaire, car il pourrait y avoir des moments ayant des implications importantes pour la maladie », explique Samantha O’Connor, co-auteure de l’étude. Cet outil, baptisé ccAF (pour cycle cellulaire ASU/Fred Hutchinson, du nom des deux institutions ayant collaboré au projet), est diffusé en open source et accessible à l’ensemble des scientifiques qui étudient les cycles cellulaires.
Lorsque Plaisier et ses collègues ont analysé les gliomes à l’aide de leur outil, ils ont découvert que les cellules tumorales se trouvaient souvent dans l’état Neural G0 ou G1. Puis, à mesure que les tumeurs deviennent plus agressives, de moins en moins de cellules restent dans l’état Neural G0, ce qui signifie que de plus en plus de cellules prolifèrent et font croître la tumeur. Leur hypothèse a été confirmée en comparant les données avec le pronostic de patients atteints de glioblastome — une tumeur cérébrale très agressive. Les patients présentant des niveaux plus élevés de cellules tumorales en phase Neural G0 avaient des tumeurs moins agressives.
Ils ont également découvert que cet état de repos Neural G0 est indépendant du taux de prolifération d’une tumeur ou de la vitesse à laquelle ses cellules se divisent et se multiplient. « La quiescence elle-même pourrait être un processus biologique différent », souligne Plaisier. Par conséquent, l’équipe estime que cet état particulier pourrait mener au développement de nouveaux traitements médicamenteux. « Si nous pouvions mener plus de cellules dans cet état de repos, les tumeurs deviendraient moins agressives », résume le spécialiste. Reste à identifier quels gènes sont responsables de cette mise en sommeil.
Cette approche pourrait par ailleurs s’avérer bien plus efficace que les traitements anticancéreux actuels, qui visent à détruire les cellules malignes. En effet, leur destruction génère des débris cellulaires dans la zone environnante de la tumeur, ce qui peut potentiellement rendre les cellules restantes plus résistantes aux médicaments. « Endormir » les cellules au lieu de les détruire permettrait ainsi de réduire les risques de récidive.