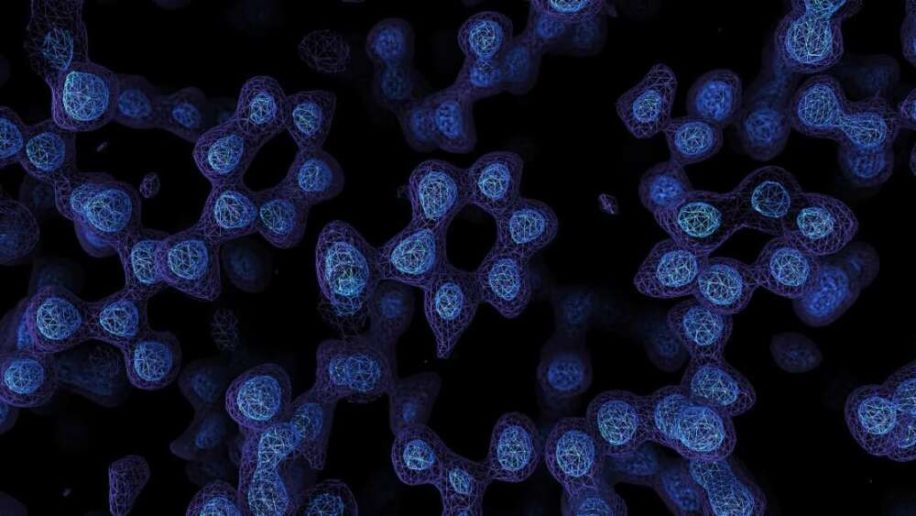
C’est à l’aide d’une technique de microscopie révolutionnaire que des scientifiques ont pu observer chacun des atomes constituant une molécule d’apoferritine — une protéine de l’intestin grêle, chargée de synthétiser la ferritine. Ces images d’une résolution incroyablement élevée ont été obtenues par cryomicroscopie électronique.
En visualisant ainsi l’infiniment petit, les chercheurs seront en mesure de comprendre, avec des détails sans précédent, le fonctionnement des protéines qui ne peuvent pas être facilement examinées par d’autres techniques d’imagerie, telles que la cristallographie aux rayons X.
La cryomicroscopie électronique, ou cryo-ME, est une technique conçue pour déterminer les structures tridimensionnelles des protéines. Elle a été développée par trois scientifiques, Jacques Dubochet, Joachim Frank et Richard Henderson, qui ont tous trois reçu le prix Nobel de chimie 2017 pour leur invention. En améliorant considérablement l’imagerie des molécules biologiques, la méthode a marqué un énorme pas en avant pour la recherche.
Zoom sur le fonctionnement des protéines
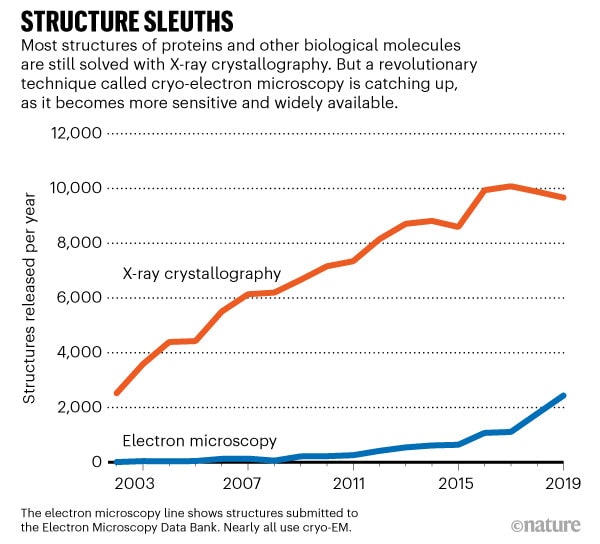
Depuis, la cryo-ME est de plus en plus utilisée. Elle est devenue l’outil incontournable de la cartographie 3D des protéines en permettant aux biologistes de mieux comprendre les processus cellulaires, comme les interactions enzymatiques ou l’action de certains médicaments. Ainsi, elle peut potentiellement conduire au développement de médicaments plus efficaces, avec moins d’effets secondaires. C’est pourquoi cette cryomicroscopie tend à remplacer la cristallographie à rayons X, largement utilisée jusqu’alors pour ses images de très haute qualité, mais qui ne fournit pas toujours un résultat : certaines protéines peuvent prendre des mois, voire des années, à cristalliser, tandis que d’autres peuvent ne jamais aboutir à une forme cristalline exploitable.
Quel est le principe de la cryo-ME ? Il s’agit de véritablement « geler » les biomolécules, en plein mouvement, afin de visualiser les processus en cours. Les échantillons sont congelés très rapidement dans de l’éthane liquide — à des températures de l’ordre de -200 °C — et sont ainsi figés dans leur état natif sous forme d’une glace amorphe. Ensuite, un faisceau d’électrons est appliqué sur l’échantillon.
Contrairement à la microscopie électronique standard, qui nécessite une préparation complexe des échantillons étudiés (fixation chimique, déshydratation, enrobage), la cryo-ME ne demande pas plus de préparation que cela ; aucun colorant ou fixateur n’est utilisé, la protéine doit simplement se trouver dans une solution purifiée. Les électrons bombardent l’échantillon, puis rebondissent contre un détecteur, qui relaye les données à un logiciel de traitement informatique qui va interpréter ces coordonnées pour reconstituer l’image 3D de la protéine examinée.
« La dernière barrière de résolution »
La cryo-ME a déjà permis de cartographier de très nombreuses molécules (la 10’000e a fait son entrée dans la base de données au mois de février 2020). Les protéines liées aux membranes cellulaires intéressent particulièrement les scientifiques, du fait qu’elles sont généralement impliquées dans les maladies et peuvent servir de cibles pour les médicaments. De par les améliorations continues du matériel et des logiciels, les structures déterminées sont de plus en plus détaillées.
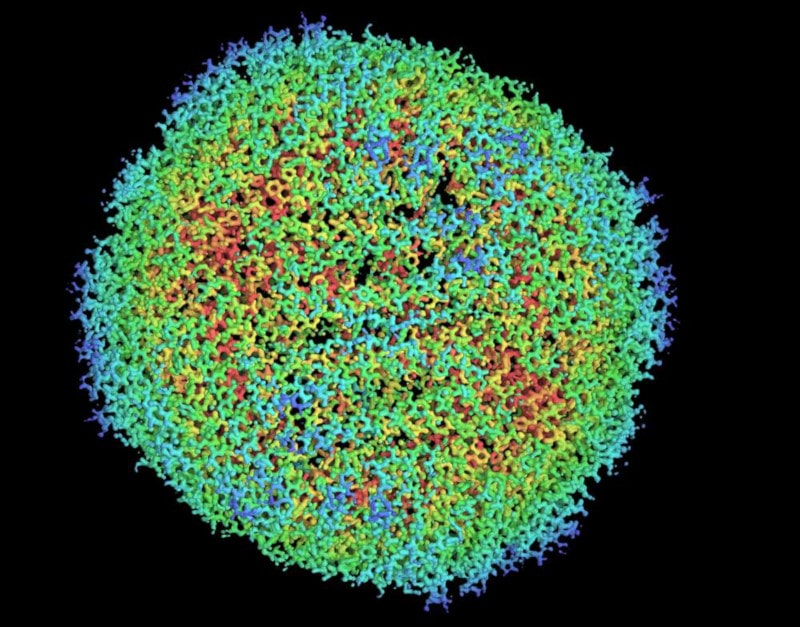
Grâce à ces progrès technologiques, une équipe de chercheurs est récemment parvenue à imager une protéine à une résolution si élevée que tous les atomes qu’elle contient étaient clairement visibles ! C’est la première fois que des atomes individuels dans une structure protéique peuvent être clairement distingués dans une image de cryomicroscopie électronique. La protéine en question, l’apoferritine — qui absorbe le fer pour former la ferritine de l’organisme — a été observée à une résolution de 1,25 ångström (1,25 x 10-10 m), battant au passage le précédent record de résolution établi à 1,54 Å.
Pour atteindre cette résolution, l’équipe d’Holger Stark, biochimiste et spécialiste en microscopie électronique à l’Institut Max Planck de chimie biophysique, a utilisé un instrument garantissant que les électrons se déplacent à des vitesses similaires avant de frapper l’échantillon, ce qui améliore la résolution des images résultantes.
Parallèlement, une équipe de chercheurs britanniques, dirigée par Sjors Scheres et Radu Aricescu, biologistes structurels au Laboratoire Conseil de recherches médicales de biologie moléculaire (MRC-LMB) à Cambridge, a obtenu une résolution de 1,2 Å. Pour ce faire, ils ont employé une technologie différente pour tirer des électrons se déplaçant à des vitesses similaires et ont également fait en sorte de réduire le bruit généré par certains électrons qui s’étaient détachés de l’échantillon. Ils ont en outre utilisé une caméra de détection plus sensible.
L’apoferritine est couramment utilisée en cryomicroscopie électronique en raison de son extrême stabilité ; elle est rapidement devenue un échantillon de test fiable pour pousser la technologie à ses limites. Mais selon certains experts, ces limites semblent être pratiquement atteintes.
Selon Holger Stark, ce dernier record de résolution constitue une amélioration limitée par rapport aux dernières découvertes. D’après lui, même en combinant les technologies utilisées par les deux équipes, il sera quasiment impossible de franchir la barre de 1Å en cryo-ME. Obtenir une telle structure avec la technologie telle qu’elle existe aujourd’hui nécessiterait « plusieurs centaines d’années d’enregistrement de données et une quantité irréaliste de puissance de calcul et de capacités de stockage de données ».