De l’hémoglobine, présente chez presque tous les mammifères, a récemment été utilisée dans un prototype innovant de batterie zinc-air. Dans ce nouveau système, cette dernière facilite la réaction de réduction de l’oxygène. Dans les batteries zinc-air conventionnelles, ce rôle est généralement assuré par des métaux précieux ou des composés à base de métaux précieux, tels que le platine ou les alliages de platine. L’hémoglobine pourrait ainsi offrir une alternative potentiellement plus écologique. Cependant, l’une des applications les plus prometteuses de cette batterie zinc-air à hémoglobine est son utilisation dans des dispositifs médicaux implantables.
L’hémoglobine, une protéine clé présente dans les globules rouges, remplit deux fonctions biologiques essentielles. Premièrement, elle facilite le transport du dioxyde de carbone des tissus vers les poumons, d’où ce dernier est ensuite expiré. Deuxièmement, elle est responsable du transport de l’oxygène depuis les poumons jusqu’aux différents tissus du corps.
C’est la capacité de cette protéine à se lier efficacement avec l’oxygène qui a suscité l’intérêt des chercheurs. Des scientifiques de l’Université de Cordoue et de l’Université polytechnique de Carthagène ont ainsi exploité cette propriété pour le développement d’un prototype de batterie zinc-air innovant fonctionnant avec de l’hémoglobine. Les détails ont été publiés dans la revue Energy & Fuels.
Un rôle de catalyseur
Il est essentiel de comprendre que le fonctionnement d’une batterie repose sur les réactions d’oxydation et de réduction de deux éléments distincts. Dans le cas de la batterie zinc-air, le zinc, situé à l’anode, subit une réaction d’oxydation et perd ainsi des électrons. À la cathode, l’oxygène présent dans l’air subit une réaction de réduction, caractérisée par un gain d’électrons — ceux précédemment perdus par le zinc. Ce flux d’électrons vers la cathode génère de l’électricité. Parallèlement, l’oxygène oxydé réagit avec l’hydrogène issu de l’électrolyte de la batterie, formant ainsi des molécules d’eau.
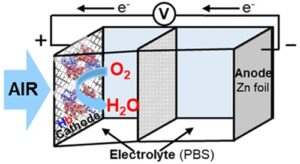
Dans ce processus, l’hémoglobine de la nouvelle batterie joue un rôle clé en agissant comme catalyseur de la réaction de réduction de l’oxygène. Les chercheurs en ont utilisé seulement 0,165 milligramme dans leur prototype. Pour rappel, un catalyseur est une substance qui accélère une réaction chimique sans être consommée.
Selon les chercheurs, l’hémoglobine remplit parfaitement les critères d’un catalyseur efficace par sa capacité naturelle à se lier rapidement et efficacement aux molécules d’oxygène. En outre, cette protéine facilite la réaction entre l’oxygène et les ions hydrogène pour produire de l’eau, un aspect également jugé très important par les chercheurs.
Une batterie non rechargeable ?
L’une des applications les plus prometteuses de cette batterie zinc-air à hémoglobine est son utilisation dans des dispositifs médicaux implantables, tels que les stimulateurs cardiaques. En raison de sa biocompatibilité et sa capacité à agir dans un environnement au pH similaire à celui du sang, l’hémoglobine est particulièrement adaptée pour une intégration dans le corps humain. L’emploi de ces batteries dans des dispositifs médicaux pourrait ainsi diminuer le risque de réaction indésirable tout en fournissant une source d’énergie plus sûre et plus stable.
Toutefois, bien que le fonctionnement du système soit prometteur, les chercheurs doivent encore relever le défi de rendre la batterie rechargeable, car la version actuelle est à usage unique. Pour cela, ils explorent la possibilité d’utiliser une autre protéine biologique qui faciliterait la recharge de la batterie. Cette protéine devrait être capable de catalyser la réaction inverse de celle de la réduction de l’oxygène, c’est-à-dire dissocier les molécules d’eau, permettant ainsi de régénérer les composants essentiels de la batterie et de la recharger.