Des chercheurs ont récemment découvert que la réactivation d’une copie du chromosome X chez les femmes explique au moins en partie leur prédisposition aux maladies auto-immunes. Naturellement désactivée dès le début du développement embryonnaire, cette copie peut se réactiver à un certain stade du vieillissement. Cela « réveillerait » ainsi des gènes censés être définitivement inactifs, dont certains régulant les cellules immunitaires.
Chez les mammifères, le sexe biologique est déterminé par la présence dans chaque cellule de deux chromosomes X pour les femelles et de chromosomes X et Y pour les mâles. Le chromosome Y ne contient que quelques gènes actifs. Il est donc tout à fait possible de vivre sans. En revanche, aucune cellule, qu’elle soit mâle ou femelle, ne peut survivre sans au moins une copie du chromosome X, qui contient plusieurs centaines de gènes actifs.
Cependant, posséder deux chromosomes X implique logiquement la production de deux fois plus de protéines spécifiques à ce chromosome, ce qui serait fatal pour les cellules. De ce fait, chaque cellule femelle au début de l’embryogenèse est programmée pour désactiver l’activité de l’une des copies de ces deux chromosomes X. Cette inactivation est ensuite maintenue dans toutes les cellules filles à venir au cours du développement fœtal et postnatal. De cette manière, les cellules femelles produisent la même quantité de protéines spécifiques que les cellules mâles, qui ne possèdent qu’un seul chromosome X.
Cependant, des chercheurs de l’Université Paris Cité et de l’Université Paul Sabatier (à Toulouse) révèlent que chez les femmes, la copie du chromosome X censée être désactivée se mettrait à se réactiver à mesure qu’elles vieillissent. Cette réactivation serait en partie impliquée dans leur prédisposition aux maladies auto-immunes. En effet, le chromosome X possède un très grand nombre de gènes impliqués dans les fonctions immunitaires, dont TLR7, TASL et CXCR3 ou CD40LG, qui ont tendance à être surexprimés dans les maladies auto-immunes.
D’autre part, des études ont montré que les hommes atteints du syndrome de Klinefelter (qui possèdent un chromosome X supplémentaire) ont un risque équivalent aux femmes de développer des troubles immunitaires relativement rares, tels que le lupus érythémateux disséminé (LED), le syndrome de Sjögren (affectant le tissu conjonctif) ou la sclérose systémique.
Cependant, les mécanismes exacts régissant ces dimorphismes sexuels marqués dans les fonctions immunitaires ne sont pas entièrement compris. Les chercheurs français ont donc exploré plus avant le phénomène dans leur nouvelle étude, récemment publiée dans la revue Science Advances.
Une réactivation liée au vieillissement
Au début de l’embryogenèse, l’inactivation de la copie du chromosome X s’effectue par le biais d’une molécule appelée « Xist ». Le gène Xist est présent au niveau de tous les chromosomes X, même chez les mâles, mais il ne s’active que lorsque ceux-ci possèdent une paire correspondante. Chez les femmes, le gène (un brin d’ARN long non codant) s’emboîte à l’une des copies du chromosome X pour stopper complètement son activité (ou à un niveau qui s’en rapproche).
Alors que dans la plupart des cellules, l’état réprimé de l’une des copies du chromosome X est maintenu, des études ont précédemment montré que cet état présente certaines spécificités au niveau des cellules immunitaires. En effet, les gènes TLR7, TASL et CXCR3 auraient tendance à échapper à la désactivation par Xist et seraient transcrits de façon substantielle dans les cellules immunitaires, même à l’état physiologique. Cette transcription est plus prononcée chez les personnes souffrant d’une maladie auto-immune.
Afin d’explorer plus avant le processus, les chercheurs de la nouvelle étude ont modifié génétiquement des souris femelles afin que l’expression du gène de désactivation Xist soit perturbée. Cela signifie que la procédure n’empêche pas complètement l’inactivation du chromosome (car cela serait fatal pour les souris), mais la diminue uniquement.
Au début, tout semblait normal et les souris ne présentaient aucun signe de pathologie ou de déclin physiologique. En revanche, des symptômes inflammatoires similaires à ceux du lupus ont commencé à apparaître à mesure qu’elles vieillissaient. Elles produisaient notamment des auto-anticorps antiacide nucléique, une surproduction de lymphocytes B liée à l’âge ainsi qu’une prolifération accrue de monocytes ou de macrophages et de cellules dendritiques.
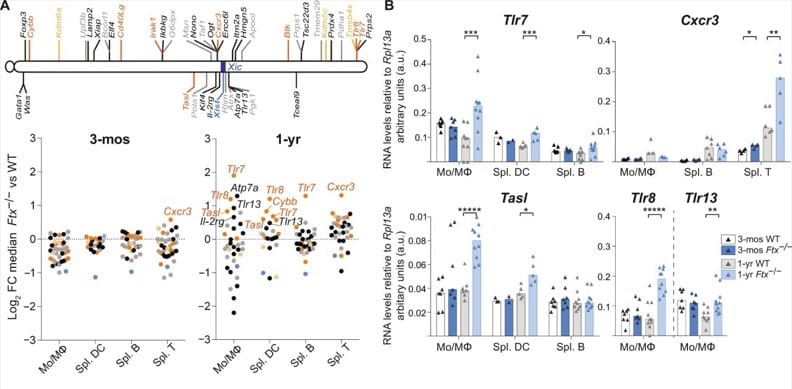


En analysant les cellules immunitaires des souris, les chercheurs ont constaté que les gènes au niveau des copies du chromosome X censées être désactivées étaient réactivés, y compris ceux régulant la voie de signalisation du TLR7 — confirmant ainsi les observations des précédentes études. Alors qu’on soupçonne que la surexpression de ce gène peut protéger les femmes contre de nombreuses maladies infectieuses, elles les rendraient également plus sujettes aux maladies auto-immunes.
Selon les experts, ces résultats s’appliqueraient à tous les mammifères et expliqueraient à la fois pourquoi les femmes sont plus vulnérables que les hommes aux maladies auto-immunes et pourquoi ces maladies (telles que la polyarthrite rhumatoïde) ont tendance à apparaître à mesure qu’elles vieillissent. La compréhension de cette corrélation pourrait potentiellement contribuer à identifier de meilleures cibles et stratégies thérapeutiques.