La multiplication cellulaire est un processus hautement contrôlé. Toutefois, dans certains cas, des lésions ou des mutations cellulaires apparaissent, les processus de contrôle deviennent inefficaces et la prolifération revêt un caractère anarchique : c’est le début du cancer. Pour rétablir les mécanismes de défense des cellules, et contourner les écueils de la chimiothérapie, des scientifiques ont découvert un moyen de cibler et détruire les cellules cancéreuses avec une extrême efficacité, en les amenant tout simplement à se suicider.
L’organisme humain est en moyenne composé d’environ cinq mille milliards de cellules réparties dans plus de 200 types cellulaires. La prolifération cellulaire au sein des tissus est strictement contrôlée et régulée ; certains tissus ne nécessitent aucun renouvellement ou un renouvellement très peu fréquent, tandis que d’autres demandent un renouvellement permanent.
Le contrôle de cette multiplication cellulaire passe par un équilibre entre facteurs activateurs (accélérateurs de prolifération) et inhibiteurs (freins ou bloqueurs de prolifération). Toute perturbation de l’homéostasie (équilibre) cellulaire peut entraîner un excès d’activation ou d’inhibition, menant à différentes pathologies.
Dans le cas du cancer, ce sont les mécanismes activateurs qui prennent le dessus, et la prolifération cellulaire devient anarchique.
Il faut alors obliger l’organisme à détruire les cellules cancéreuses pour endiguer cette prolifération. Actuellement, les traitements passent par la chimiothérapie et la radiothérapies ; des traitements lourds aux nombreux effets secondaires. Une situation qui pourrait être sur le point de changer. Dans deux publications parues dans les revues Nature Communications et eLIFE, des chercheurs ont mis au point une nouvelle stratégie reposant sur les mécanismes de défense déjà présents dans les cellules.
Contrôle de la prolifération cellulaire, lésions de l’ADN et mort cellulaire
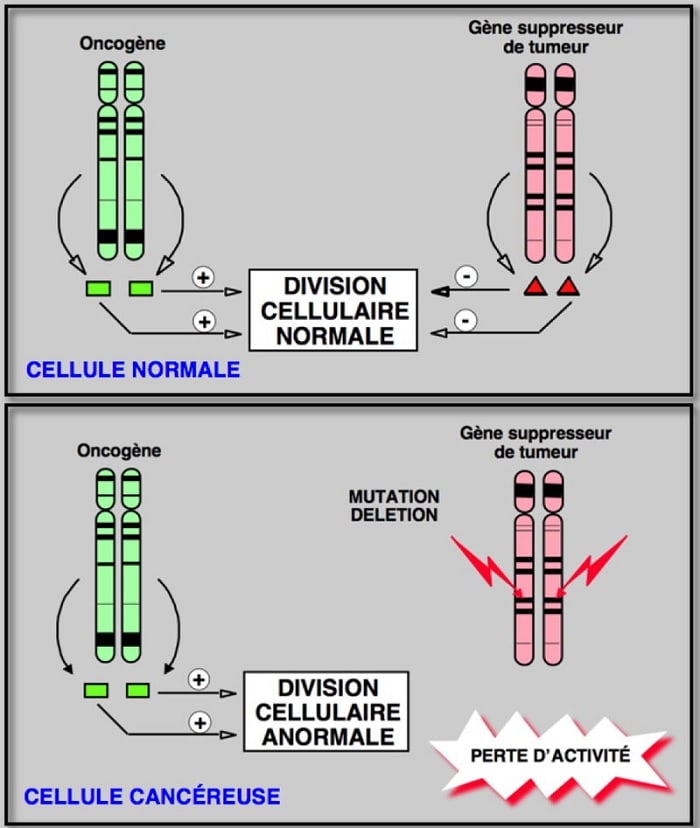
Trois gènes importants interviennent dans la prolifération cellulaire et ses déséquilibres. Les oncogènes, des gènes régulateurs positifs de la multiplication cellulaire ; en cas de cancer, ils deviennent hyper-actifs. Puis il y a les gènes suppresseurs de tumeur, qui sont des régulateurs négatifs : en cas de cancer, ils sont inactivés. Et enfin, les gènes réparateurs, qui commandent les mécanismes de réparation de l’ADN en cas de lésions et de mutations : ils sont également inactivés dans le cancer.
Sur le même sujet : Les cellules tueuses naturelles modifiées pourraient bien être au cœur de la prochaine grande immunothérapie du cancer
Lorsque l’ADN entre en phase de duplication (division), des mécanismes moléculaires veillent à ce que le processus de copie ne contienne pas d’erreurs génétiques. Même si ce contrôle est extrêmement rigoureux, il n’est pas rare que des erreurs conduisant à des mutations passent entre les mailles du filet. De la même manière, l’exposition de l’ADN à des substances cancérogènes ou des rayonnements ionisants peut entraîner des lésions génomiques.
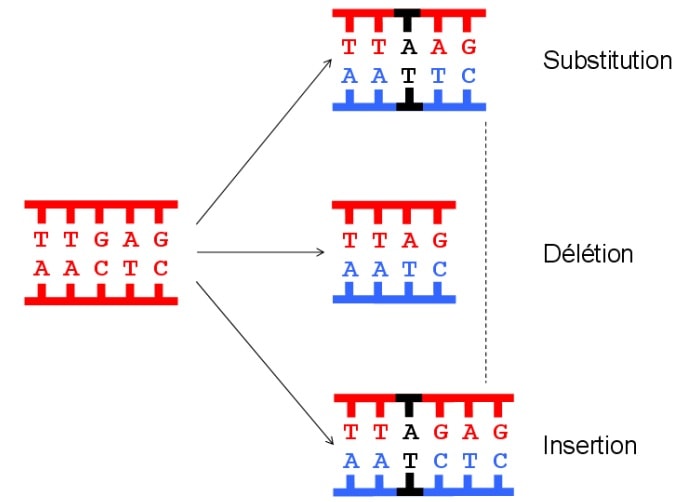
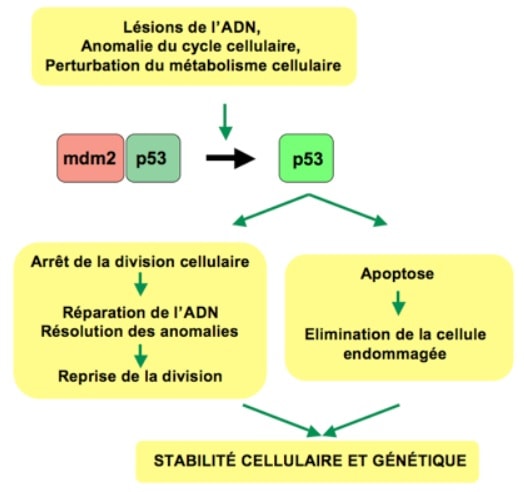
Quand ces lésions et mutations sont détectées, les gènes réparateurs sont activés de manière à venir réparer le brin d’ADN endommagé. Si des réparations sont possibles, alors la division cellulaire est arrêtée, les réparations sont effectuées, et la division peut reprendre. Si les dommages sont trop importants, alors un facteur de transcription particulier, appelé p53, intervient pour déclencher la mort de la cellule afin d’empêcher toute prolifération anormale : c’est l’apoptose.
L’apoptose est un mécanisme de mort cellulaire programmée, intégré au génome de toutes les cellules de l’organisme. Il peut être activé de deux manières. Premièrement, il peut se produire naturellement au bout d’un certain nombre de divisions d’une cellule ; cela peut être assimilé à une mort pour cause de vieillesse. Secondairement, il peut être activé sur commande de p53, lorsqu’une cellule est trop endommagée.
Une fois l’apoptose déclenchée, plusieurs sous-processus sont simultanément mis en oeuvre pour détruire la cellule le plus rapidement possible : désintégration du cytosquelette, fragmentation du noyau, arrêt de la réplication, lyse de la membrane plasmique, etc. Et pour permettre ces actions, p53 oblige la cellule à cesser toute synthèse protéique et enzymatique.
Cela est rendu possible par la production d’ARN interférents (acide ribonucléique simple ou double brin) s’appariant de manière spécifique à des ARNm (ARN messagers intervenant dans le processus de traduction, c’est-à-dire la synthèse de protéines). L’appariement ARNi/ARNm entraîne la dégradation de l’ARNm et donc l’arrêt de la production de protéines par la cellule. Sans protéines ni enzymes pour assurer sa régulation interne, la cellule meurt.
Des cellules cancéreuses immortelles
Il arrive parfois qu’une mutation touche directement les gènes oncogènes, les gènes suppresseurs de tumeur, les gènes réparateurs, voire même directement p53. C’est le cas dans le cancer où les gènes suppresseurs et réparateurs subissent des mutations ou des lésions, les rendant ainsi inactifs, tandis que les oncogènes peuvent être sur-exprimés.
Et si p53 est aussi touché, alors l’apoptose est désactivée, et la cellule peut commencer à se diviser de manière anarchique : elle devient cancéreuse. Il n’existe alors plus aucun mécanisme pour inhiber ou bloquer la multiplication cellulaire anormale, la cellule cancéreuse devient ainsi virtuellement immortelle.
Dans ce cas, il est alors nécessaire d’activer artificiellement les gènes à l’origine des ARN interférents pour bloquer et détruire la cellule. C’est l’objectif des chimiothérapies, dont le fonctionnement est de se substituer à p53 en forçant la production d’ARNi. Toutefois, malgré de récentes évolutions dans le domaine, la chimiothérapie reste un traitement extrêmement lourd et quelque fois aspécifique : il déclenche l’apoptose également chez les cellules saines.
En outre, dans certains cas, les cellules cancéreuses développent une résistance à la molécule chimiothérapeutique utilisée, ce qui en diminue grandement les effets. L’objectif des chercheurs a donc été double : identifier un moyen de ne cibler que les cellules cancéreuses, tout en évitant le développement d’une résistance cellulaire.
Une mort cellulaire imposée aux cellules cancéreuses
En 2017, une équipe américaine de biologistes moléculaires et de médecins de l’université de Northwestern ont synthétisé 4666 ARNi différents (des combinaisons de seulement 6 nucléotides) dirigés spécifiquement contre un récepteur cellulaire particulier, appelé CD95. En effet, des travaux précédents ont montré que la séquence génétique de CD95 contenait des éléments (promoteurs) impliqués dans les activités cancéreuses.
À la surprise des chercheurs, ces ARN interférents se sont révélés extrêmement efficaces et toxiques pour les cellules cancéreuses. Au lieu de ne déclencher qu’une voie de la mort cellulaire, ces ARNi déclenchent simultanément plusieurs voies apoptotiques.
Même si la cellule développe une résistance à un ou deux de ces mécanismes de destruction, ces derniers sont trop nombreux pour pouvoir être contrés. En d’autres mots, c’est comme si une personne se suicidait en utilisant simultanément des dizaines de moyens différents.
Dans ces deux études de 2018, les chercheurs, après avoir examiné minutieusement 4096 des 4666 combinaisons étudiées précédemment, ont isolé l’ARNi le plus toxique ciblant le complexe CD95. Plus précisément, ils ont découvert que cibler l’ARNm responsable du ligand (protéine se fixant à un récepteur) appelé Fas, se fixant à CD95, entraînait une destruction spécifique et inéluctable de toute cellule cancéreuse lors de tests effectués sur des lignées cellulaires cancéreuses humaines et murines.
En outre, cet ARNi s’avère être déjà présent naturellement dans les cellules humaines. Il s’agirait d’un mécanisme apoptotique évolutivement conservé, puisqu’il serait apparu il y a environ 800 millions d’années dans le génome des cellules eucaryotes. Même si un long travail attend encore les chercheurs, pour Marcus E. Peter, auteur principal d’une des deux études, ces résultats permettront de développer des ARN interférents artificiels encore plus efficaces que les mécanismes de défense naturels des cellules.