Notre volonté de rajeunissement est presque omniprésente dans nos sociétés. Si l’aspect physique « jeune » est l’un des objectifs, un autre est la possibilité d’enrayer le déclin progressif des mécanismes cellulaires, vecteurs de maladies, qu’elles soient chroniques, neurodégénératives, etc. D’ailleurs, la population mondiale est vieillissante. Selon les Nations Unies, une personne sur six dans le monde aura plus de 65 ans (16%) d’ici 2050, contre une sur onze en 2019 (9%). Récemment, des chercheurs ont mis au point une nouvelle méthode permettant d’inverser le vieillissement de cellules humaines de 30 ans, une révolution pour la médecine régénérative.
Le vieillissement est un processus continu et progressif d’altération naturelle qui commence tôt dans l’âge adulte. Au début de l’âge mûr, de nombreuses fonctions corporelles commencent à décliner progressivement. Du point de vue biologique, le vieillissement est donc le produit de l’accumulation d’un vaste éventail de dommages moléculaires et cellulaires au fil du temps. Celles-ci entraînent une dégradation progressive des capacités physiques et mentales, une majoration du risque de maladie et, enfin, le décès. Ces changements ne sont ni linéaires ni réguliers et ne sont pas étroitement associés au nombre d’années. Cependant, même s’il est inéluctable, le vieillissement est influençable.
C’est pourquoi la médecine régénérative offre de grands espoirs. Cette dernière vise à réparer, remplacer ou régénérer des gènes, des cellules ou des organes défaillants afin de rétablir un fonctionnement normal. Elle a donc le potentiel d’inverser les changements liés à l’âge. Les traitements consistent à greffer au patient, dans la zone endommagée, des cellules réparatrices. Une fois nichées dans l’organe ciblé (ou à proximité), celles-ci accomplissent elles-mêmes le travail, reconstituant un tissu sain. Ces cellules réparatrices sont les cellules souches. En termes simples, ce sont des cellules non spécialisées — indifférenciées — capables de s’autorenouveler à l’infini et de donner naissance, selon le milieu où elles baignent, aux diverses cellules constitutives du tissu.
La technique permettant d’obtenir ces cellules est un processus de conversion des cellules somatiques en cellules souches pluripotentes induites (iPSC). Il consiste à prélever pratiquement n’importe quelle cellule chez un adulte et à la reprogrammer génétiquement pour la rendre pluripotente, c’est-à-dire capable de se multiplier à l’infini et de se différencier dans tous les types de cellules qui composent un organisme adulte — comme une cellule souche embryonnaire.
Malheureusement, ces cellules iPSC, suite aux nombreuses étapes nécessaires à leur reprogrammation, perdent certaines de leurs fonctions spécifiques, acquises avec l’âge. Elles ressemblent souvent à des cellules fœtales plutôt qu’à des cellules adultes matures. Récemment, une équipe de chercheurs de l’Institut Babraham à Camdbrige a mis au point une méthode afin de reprogrammer des cellules de manière à les rendre biologiquement plus jeunes tout en étant capables de retrouver leur fonction cellulaire spécialisée. L’étude a été publiée dans la revue eLife.
Remonter le temps jusqu’au « bon moment »
Dans l’objectif de conserver les spécificités des cellules tout en les faisant rajeunir, les chercheurs s’appuient sur les travaux de Shinya Yamanaka qui, en 2007, a été le premier scientifique à démontrer la capacité à transformer des cellules normales en cellules souches. Ce processus prend environ 50 jours en utilisant quatre molécules clés appelées les « facteurs Yamanaka ». Cette prouesse technique lui a valu, en 2012, le prix Nobel de physiologie et médecine. Par ailleurs, des travaux récents ont démontré que l’épigénome — ensemble des modifications d’une cellule altérant l’expression des gènes sans modifier la séquence de l’ADN sous-jacent — est déjà rajeuni par la première étape de la reprogrammation (phase de maturation). Ceci suggère qu’une reprogrammation iPSC complète n’est pas nécessaire pour inverser le vieillissement des cellules somatiques.
En conséquence, les chercheurs ont utilisé des fibroblastes dermiques de donneurs d’âge moyen, pour trouver à quel moment il faut stopper le processus de reprogrammation. Dans un premier temps, ils les ont exposés aux facteurs Yamanaka, et ont constaté que les cellules perdaient temporairement, puis retrouvaient, leur identité de fibroblaste, après seulement 13 jours. Ceci pourrait être dû à la mémoire épigénétique au niveau des activateurs et/ou de l’expression persistante de certains gènes des fibroblastes. Cette nouvelle méthode est baptisée « reprogrammation transitoire de la phase de maturation ».
Le vieillissement, question d’âge chronologique ou biologique ?
Comme l’explique le Dr Diljeet Gill dans un communiqué, postdoctorant dans le laboratoire de Wolf Reik à l’Institut (qui a mené les travaux en tant que doctorant) : « Notre compréhension du vieillissement au niveau moléculaire a progressé au cours de la dernière décennie, donnant naissance à des techniques qui permettent aux chercheurs de mesurer les changements biologiques liés à l’âge dans les cellules humaines. Nous avons pu appliquer cela à notre expérience pour déterminer l’étendue de la reprogrammation de notre nouvelle méthode ».

En effet, pour vérifier si le processus de régénération avait abouti, ils ont examiné d’une part ce que l’on appelle l’horloge épigénétique ; d’autre part le transcriptome. Ce dernier correspond à l’ensemble des molécules d’ARN messager d’une cellule, répliques des gènes qui sont à l’état actif dans une cellule. De son côté, l’horloge épigénétique est un modèle mathématique qui prédit l’âge en mesurant les niveaux de méthylation de l’ADN dans différents sites du génome.
Il faut savoir que la méthylation de l’ADN est un processus par lequel des groupes méthyle sont ajoutés à la molécule d’ADN, ce qui peut modifier la fonction d’un gène sans changer la séquence d’ADN sous-jacente. Cette méthylation de l’ADN est essentielle à la croissance et au développement sains des cellules et elle est affectée par le mode de vie et les facteurs environnementaux. Les horloges épigénétiques peuvent donc être utilisées pour estimer l’âge biologique d’un tissu, d’un type de cellule ou d’un organe, en comparant « l’âge de méthylation de l’ADN » (ou l’âge biologique) avec l’âge chronologique, dans différents tissus. En utilisant ces deux mesures, les cellules reprogrammées correspondaient au profil des cellules qui avaient 30 ans de moins par rapport aux ensembles de données de référence.
Implications pour la médecine régénérative
Par suite, l’analyse a montré que les cellules avaient retrouvé des marqueurs caractéristiques des cellules de peau, notamment par l’observation de la production de collagène dans les cellules reprogrammées. Les fibroblastes produisent du collagène. Cette molécule est présente dans les os, les tendons de la peau et les ligaments, et aide à structurer les tissus et à cicatriser les plaies. Les chercheurs ont noté une production plus importante de collagène par les fibroblastes rajeunis que par les cellules témoins (n’ayant pas subi le processus de reprogrammation).
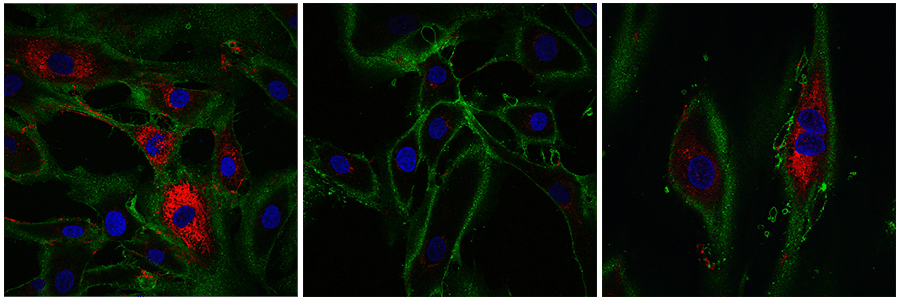


De plus, in vivo, les fibroblastes se déplacent dans les zones qui doivent être réparées. Les chercheurs ont alors testé cette capacité chez les cellules partiellement rajeunies. Dans cet objectif, ils ont incisé une couche de cellules, à l’image d’une coupure de la peau. Ils ont découvert que leurs fibroblastes traités se déplaçaient plus rapidement dans l’espace que les cellules plus anciennes. Les chercheurs soulignent que c’est un signe prometteur quant à la possibilité future de créer des cellules capables de mieux cicatriser les plaies.
Enfin, l’analyse du transcriptome, mentionnée plus haut, a mis en évidence des signes de rajeunissement au niveau de deux gènes particuliers impliqués dans les maladies et symptômes liés à l’âge : le gène APBA2, associé à la maladie d’Alzheimer, et le gène MAF, jouant un rôle dans le développement de la cataracte. Le professeur Wolf Reik, qui dirige la recherche, déclare : « Ce travail a des implications très intéressantes. À terme, nous pourrons peut-être identifier des gènes qui rajeunissent sans reprogrammation, et cibler spécifiquement ceux qui réduisent les effets du vieillissement ».
Effectivement, même si le mécanisme derrière la reprogrammation transitoire n’est pas encore entièrement compris, les scientifiques pensent que des zones clés du génome, impliquées dans la formation de l’identité cellulaire, pourraient échapper au processus de reprogrammation. Gill conclut : « Nos résultats représentent un grand pas en avant dans notre compréhension de la reprogrammation cellulaire. Nous avons prouvé que les cellules peuvent être rajeunies sans perdre leur fonction et que le rajeunissement cherche à restaurer certaines fonctions des vieilles cellules. Le fait que nous ayons également observé une inversion des indicateurs de vieillissement dans les gènes associés aux maladies est particulièrement prometteur pour l’avenir de ces travaux ».



