Des chercheurs ont développé un nouveau composé permettant de stimuler la différenciation des oligodendrocytes régénérateurs de myéline, permettant ainsi de réparer les lésions dues à la sclérose en plaques. Le composé agit en bloquant le récepteur MR1, spécifiquement situé au niveau des cellules précurseurs d’oligodendrocytes et identifié à l’aide du venin de mamba vert.
Les maladies dites « démyélinisantes » telles que la sclérose en plaques (SEP) entraînent un dysfonctionnement neuronal provoqué par la perturbation de la transmission des signaux nerveux au niveau des axones. Cela est dû à la dégradation de la gaine de myéline qui les entoure, qui assure à la fois l’isolement et la fluidité de la transmission nerveuse. Les symptômes de la maladie peuvent être sensoriels et moteurs, incluant des difficultés à contrôler les membres et parfois la perte de vision.
La destruction de la myéline est à la fois engendrée par une réponse inflammatoire exacerbée et une incapacité à restaurer efficacement cette gaine. En effet, certaines régions démyélinisées peuvent se remyéliniser spontanément. Cependant, ce processus est généralement limité, surtout dans le cas de la SEP. À mesure que la maladie progresse, les patients entrent dans une phase chronique de dysfonctionnement neuronal dû à la perte croissante d’axones.
Les thérapies actuelles contre la SEP se concentrent sur l’immuno-modulation afin de limiter l’inflammation et la perte supplémentaire de myéline. Cependant, ces stratégies permettent uniquement de ralentir la progression de la maladie. Afin d’identifier des cibles thérapeutiques permettant de stopper la progression de la maladie, de plus en plus de recherches se concentrent sur les mécanismes biomoléculaires permettant la remyélinisation.
Dans cette vision, des chercheurs de l’Université de Californie à San Francisco (UCSF) et de Contineum Therapeutics ont identifié un récepteur dont l’inhibition permet de restaurer efficacement le processus de remyélinisation. « En étudiant attentivement la biologie de la remyélinisation, nous avons développé une thérapie précise pour l’activer – la première d’une nouvelle classe de thérapies contre la SEP », explique Jonah R. Chan de l’UCSF, coauteur principal de l’étude récemment parue dans la revue PNAS.
Un médicament ciblant un seul récepteur
Les oligodendrocytes, les cellules responsables de la myélinisation des axones, sont progressivement perdus chez les patients souffrant de SEP. Bien qu’abondantes et pouvant migrer au niveau des sites de lésion, les cellules précurseurs d’oligodendrocytes (OPC) ne parviennent pas à se différencier en oligodendrocytes. Il a été suggéré que cela est dû à un microenvironnement inhibiteur empêchant la différenciation des OPC. La restauration de ce processus de différenciation constitue depuis peu un domaine de recherche très actif dans l’espoir de stopper, voire inverser les symptômes de la maladie.
Des études ont précédemment montré que les composés antimuscariniques favorisaient la différenciation des OPC. Il s’agit de récepteurs largement distribués au niveau des muscles et des organes, y compris le cerveau. Parmi ces composés figurent par exemple la benzotropine (habituellement utilisée pour traiter la maladie de Parkinson) et la clémastine (un antihistaminique courant). Les précédents essais cliniques menés par Chan et ses collègues pour la clémastine ont montré que le composé pouvait réactiver la remyélinisation.
Cependant, l’efficacité de la clémastine était relativement limitée, probablement en raison de son manque de sélectivité. « La clémastine n’est pas un médicament ciblé, qui agit sur plusieurs voies différentes dans le corps », explique Ari J. Green de l’UCSF, également co-auteur de l’étude. « Mais dès le départ, nous avons vu que sa pharmacologie avec les récepteurs muscariniques pourrait nous orienter vers la prochaine génération de thérapies réparatrices dans la SEP », indique-t-il.
Les chercheurs ont par la suite identifié le récepteur muscarinique de l’acétylcholine M1 (M1R) comme étant essentiel à la différenciation des OPC. Des souris génétiquement modifiées pour être dépourvues de ce récepteur ont notamment montré une remyélinisation accélérée. Cela signifie que la clémastine peut cibler plusieurs récepteurs muscarinique, mais que son effet sur les OPC est dû au blocage d’un seul récepteur. Les derniers travaux de l’équipe consistaient à explorer en détail les mécanismes du récepteur à l’aide d’approches chimiques et biologiques.
Un récepteur identifié à l’aide du venin de mamba vert
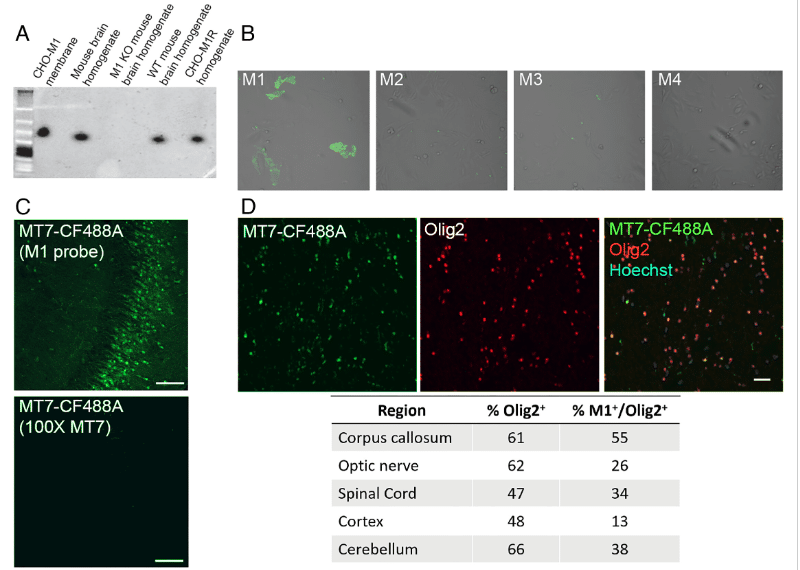
Afin de déterminer si le récepteur M1R était la meilleure cible pour réactiver la différenciation des OPC, l’équipe a utilisé le MT7, une toxine présente dans le venin du mamba vert (Dendroaspis angusticeps). Cette toxine est en effet hautement spécifique au récepteur M1R, ce qui permet de s’en servir comme marqueur pour déterminer avec précision la position de ce dernier. « Nous devions prouver, sans l’ombre d’un doute, que M1R était présent dans les OPC qui se trouvaient à proximité des lésions causées par la sclérose en plaques », explique Michael M. Poon de Contineum Therapeutics, auteur principal de l’étude.
En utilisant le marqueur à base de MT7, les chercheurs ont pu confirmer de manière fiable que M1R se trouve bien au niveau des OPC. Les récepteurs M1R se rassemblent en formant des anneaux autour des lésions au niveau de la gaine de myéline chez les souris souffrant de SEP induite, ainsi que dans les échantillons de tissus de patients souffrant de SEP.


Les chercheurs ont alors développé une molécule (PIPE-307) ciblant spécifiquement MR1. Les effets du composé sur la remyélinisation ont été évalués in vitro et in vivo sur des modèles animaux de SEP. Il a été constaté qu’il inhibe le récepteur M1R avec une efficacité significativement plus élevée que la clémastine, permettant ainsi de différencier les OPC en oligodendrocytes et de remyéliniser les axones endommagés. Le composé traverse facilement la barrière hématoencéphalique et permet une récupération de la fonction nerveuse.
L’innocuité du composé a été démontrée avec succès lors d’essais cliniques de phase 1 et des essais de phase 2 sur des patients SEP sont en cours. Si les résultats sont concluants, « nous aurions désormais la possibilité non seulement de stopper la maladie, mais aussi de la guérir », conclut Green.