Un médicament neuroprotecteur s’est montré incroyablement efficace pour atténuer les symptômes de la sclérose en plaques (SEP) et promouvoir la restauration de la myéline chez des modèles murins. Il peut notamment réduire la réponse immunitaire délétère inhérente à maladie au niveau du système nerveux central, sans affecter globalement son fonctionnement. En vue de ces résultats prometteurs, un premier essai clinique adaptatif pour la SEP progressive débutera dès janvier prochain.
La SEP est une maladie affectant près de 2 millions de personnes dans le monde et englobant un large éventail de symptômes, tels que le déclin cognitif et de la coordination, une faiblesse musculaire (allant jusqu’à la paralysie dans les cas les plus graves), de l’incontinence, des problèmes digestifs ainsi que des symptômes dépressifs. Étant une maladie auto-immune selon nos connaissances actuelles, elle se manifeste par un ciblage exacerbé de la gaine de myéline entourant les axones par les lymphocytes T CD4+ du système immunitaire. Cela entraîne une inflammation du système nerveux central provoquant une démyélinisation généralisée par plaques (les zones spécifiques qui subissent les attaques immunitaires).
La plupart des traitements contre la SEP se focalisent sur la modulation du système immunitaire, notamment dans le but de réduire l’inflammation à l’origine de la démyélinisation. Cependant, il n’existe que très peu de thérapies pour les formes dites « progressives » de la maladie, qui se manifestent par une inflammation chronique plus agressive et une neurodégénérescence accrue. Le manque de compréhension de ces formes complexes de la maladie a notamment considérablement entravé le développement de thérapies dédiées.
D’un autre côté cependant, une hypothèse récente suggère que la SEP est principalement ou initialement une maladie neurodégénérative, au cours de laquelle une perte neuronale initiale libère de la myéline qui, à son tour, enclenche une réponse auto-immune secondaire. Des stratégies neuroprotectices réduisant la quantité de myéline libérée pourraient ainsi agir en amont des réactions auto-immunes, quelle que soit la forme de SEP ciblée et son stade.
Dans cette vision, le nouveau médicament expérimental codéveloppé par des chercheurs du Centre canadien de toxicomanie et de santé mentale (CAMH), cible l’excitotoxicité du glutamate. Il s’agit d’un processus pathologique au cours duquel le glutamate, un neurotransmetteur essentiel à la mémoire et à l’apprentissage, peut induire la perte de cellules neurales potentiellement à l’origine de la libération de myéline. L’inhibition de cette voie pourrait ainsi induire une neuroprotection.
Une amélioration significative dès 13 jours de traitement
De précédentes études ont confirmé l’implication de l’excitotoxicité du glutamate dans la SEP. L’une d’entre elles rapporte par exemple un excès de glutamate dans le liquide céphalo-rachidien de patients, ainsi qu’une suractivation des récepteurs appelés AMPA et NMDA, auxquels se lie le neurotransmetteur. En temps normal, le premier régule la transmission de l’influx nerveux, tandis que le second contrôle la plasticité cérébrale. Cependant, la plupart des approches visant à inhiber ces récepteurs ont entraîné de graves effets secondaires.
De leur côté, les chercheurs de la nouvelle étude ont précédemment découvert que la sous-unité (ou fragment) GluA2 du récepteur AMPA était spécifiquement impliquée dans la perte neuronale d’origine excitotoxique. Dans le cadre de leur nouvelle étude, publiée dans la revue Science Advances, les experts suggèrent que l’inhibition de cette sous-unité permet une approche plus ciblée pour réduire les déficits neurologiques et la démyélinisation associés à la SEP. En d’autres termes, cela pourrait offrir une neuroprotection sans impacter les autres mécanismes du système nerveux central.
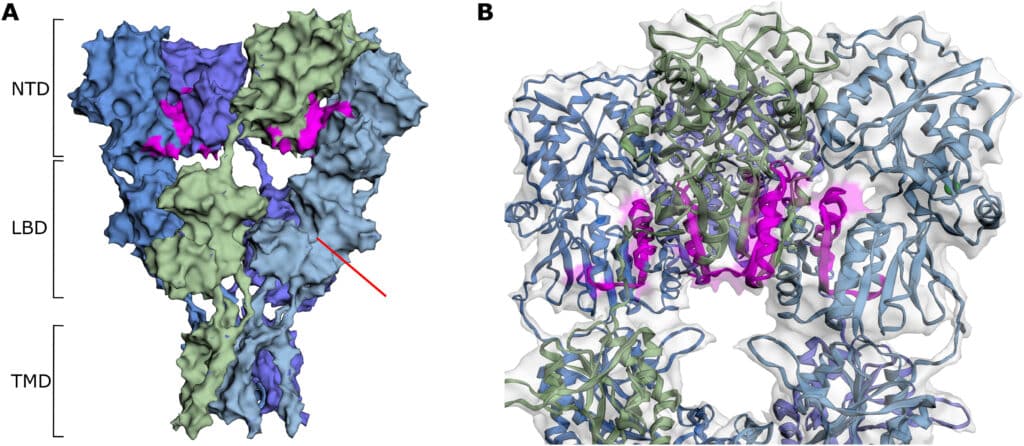
Afin d’identifier une molécule pouvant cibler spécifiquement le GluA2 AMPA, les chercheurs de l’étude se sont basés sur l’apprentissage automatique. Parmi les molécules analysées, 50 candidates ont été sélectionnées, afin de tester leur capacité d’inhibition de l’excitotoxicité médiée par le glutamate. Après analyse, 3 composés prometteurs ont été identifiés, dont l’un — nommé ZCAN262 — s’est démarqué par sa stabilité et son efficacité d’inhibition in vitro.
Les essais in vivo sur des modèles murins d’encéphalite auto-immune et de « cuprizone MS » (sclérose en plaques induite par la cuprizone) ont montré que le ZCAN262 améliorait significativement les fonctions cognitives et motrices dès le 13e jour de traitement. Les modèles d’encéphalite auto-immune expérimentale sont les modèles animaux utilisés pour la recherche sur le SEP, tandis que le cuprizone MS est celui utilisé comme modèle de démyélinisation.
« Le candidat principal a des effets puissants sur la restauration de la fonction neurologique et de la myélinisation tout en réduisant la réponse immunitaire dans les modèles expérimentaux d’encéphalite auto-immune et de souris à cuprizone MS, sans affecter la neurotransmission basale, l’apprentissage et la mémoire », ont indiqué les chercheurs dans leur étude. Cela signifie que contrairement aux précédentes thérapies basées sur la même approche, la molécule ne provoque pas d’effets secondaires sur l’ensemble du système nerveux central.
En prochaine étape, les chercheurs prévoient d’explorer plus avant l’innocuité et la stabilité du médicament. Parallèlement, un premier essai clinique adaptatif destiné aux Australiens souffrant de SEP progressive débutera dès ce mois de janvier. L’essai clinique adaptif est une nouvelle approche au cours de laquelle les modifications des paramètres de l’essai sont planifiées, par rapport aux données des participants.