Une nouvelle technique de microscopie permet pour la première fois d’observer en direct et en haute résolution le processus par lequel les virus de la grippe pénètrent les cellules. Combinant deux puissants outils d’imagerie, la technique a mis en lumière la manière dont les cellules tentent activement de se défendre avant d’être infectées. La technologie pourrait contribuer au développement de thérapies antivirales plus efficaces et plus ciblées.
Les virus de la grippe utilisent leurs protéines de surface, dites hémagglutinines, pour pénétrer et infecter les cellules. Plus précisément, elles interagissent avec les molécules d’acides sialiques présentes au niveau des glycolipides et des glycoprotéines structurant la surface des cellules. La fixation stable à la surface de la cellule s’effectue par le biais de liaisons multivalentes entre plusieurs hémagglutinines et acides sialiques.
Une enzyme appelée neuraminidase induit ensuite la rupture des acides sialiques, permettant au virus de pénétrer à l’intérieur de la cellule. L’interaction compétitive entre les hémagglutinines et l’enzyme permet au virus de se diffuser latéralement le long de la membrane cellulaire. Il s’agit notamment d’un processus cellulaire dynamique essentiel au fonctionnement des cellules (pour l’absorption de substances vitales telles que les hormones) que les virus détournent afin de les infecter.
La diffusion latérale à la surface de la cellule permet au virus d’identifier le point d’entrée idéal pour la pénétrer, c’est-à-dire la région de la membrane où de nombreuses molécules réceptrices sont regroupées. Une cavité stabilisée par une protéine spécifique appelée clathrine se forme ensuite à cet endroit pour englober le virus à l’intérieur d’une vésicule. Cette vésicule migre vers l’intérieur de la cellule pour se dissoudre, libérant ainsi les protéines virales.
L’observation de ce processus membranaire dynamique est essentielle à la compréhension du potentiel des virus grippaux à infecter les cellules. Cependant, les techniques de microscopie conventionnelles ne disposent pas de la résolution suffisante pour détecter les mouvements de ces virus au niveau des membranes cellulaires, dont l’épaisseur de la bicouche lipidique est d’environ 5 à 10 nanomètres.
La microscopie électronique a été proposée pour observer le processus, mais bien qu’elle dispose d’une résolution relativement élevée, son utilisation implique la destruction des cellules, ce qui n’offre qu’une image instantanée. La microscopie à fluorescence a aussi été utilisée, mais n’offrait pas de résolution spatiale suffisamment élevée.
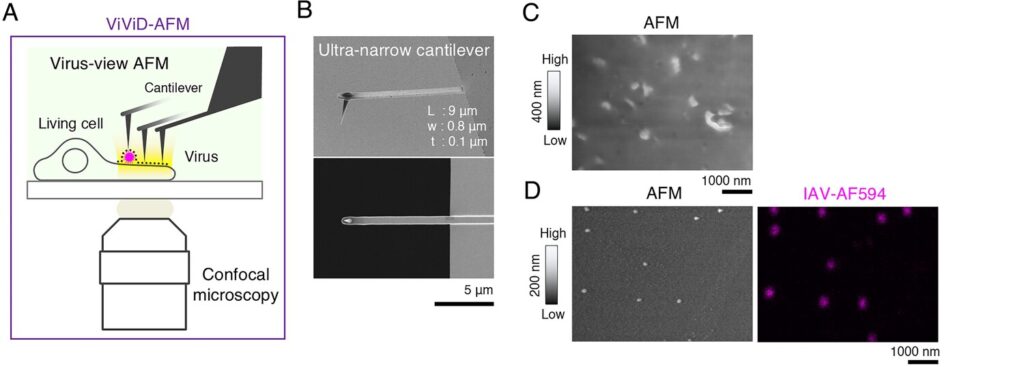
Une équipe codirigée par l’Université de Zürich, en Suisse, et l’Université d’Hokkaido, au Japon, propose une nouvelle technique combinant la microscopie à force atomique (AFM) et la microscopie à fluorescence, offrant une résolution inédite. Le système hybride a permis d’observer pour la première fois en direct le moment exact où le virus de la grippe interagit avec la membrane cellulaire.
« … une danse entre le virus et la cellule »
Baptisée microscopie confocale et AFM double pour l’observation des virus (ViViD-AFM), la nouvelle technique permet de suivre en détail le mécanisme par lequel le virus pénètre et infecte sa cellule hôte. Si des marqueurs fluorescents sont généralement utilisés pour l’observation des virus au microscope, la technique permet de les suivre même sans marquage. Elle permet d’observer simultanément les changements de forme de la cellule et les signaux émis par les virus.
« Dans cette étude, nous avons abordé et surmonté le problème des interférences mécaniques en améliorant la faible invasivité de la microscopie à force atomique (AFM) grâce à l’utilisation d’un levier souple sur mesure », expliquent les chercheurs dans leur étude publiée dans la revue PNAS. « Combinée à la microscopie confocale, l’AFM faiblement invasive permet l’imagerie simultanée de cellules vivantes, tant de leur morphologie que de leur fluorescence. »
Les observations en haute résolution ont mis en évidence un mécanisme inédit. Contrairement à ce que l’on supposait, les cellules ne restaient pas passives mais semblaient se défendre activement en s’étirant, se déplaçant et en tentant de saisir le virus pour essayer d’en prendre le contrôle. La surface cellulaire se bombait à des endroits précis et induisait des mouvements ondulatoires qui s’intensifiaient lorsque le virus tentait de s’en éloigner.
« L’infection de nos cellules est comme une danse entre le virus et la cellule », compare dans un communiqué de l’ETH Zürich, Yohei Yamauchi, professeur de médecine moléculaire à l’ETH Zürich et au Département de virologie de la faculté de médecine à l’Université de Nagoya, qui a dirigé l’étude.
D’après les chercheurs, la technique pourrait contribuer au développement de nouveaux médicaments antiviraux, par exemple en permettant de tester en temps réel à l’échelle cellulaire leur efficacité in vitro. Elle permettrait aussi d’étudier le comportement d’autres types de virus avec des formes et des mécanismes d’infection variés, ainsi que celui des vaccins.
Vidéo de présentation de l’étude: