Des chercheurs ont développé le MEDY, un nouveau cocktail chimique permettant de congeler et de décongeler des tissus cérébraux sans les endommager. Après avoir été pré-trempées dans la solution puis cryogénisées dans de l’azote liquide, les cellules ont retrouvé une fonction normale jusqu’à 18 mois après avoir été congelées. Cette technique de conservation devrait permettre de considérablement améliorer l’accès aux échantillons cérébraux de qualité pour les recherches biomédicales.
La culture d’organoïdes constitue l’une des plus grandes avancées de la recherche biomédicale ces dernières années. Ces amas de cellules ont notamment permis de reproduire la plupart des maladies cérébrales, permettant ainsi d’étudier leurs mécanismes biomoléculaires ainsi que le développement de nouveaux médicaments. Cependant, leur disponibilité est considérablement limitée en raison du temps et des coûts élevés nécessaires à leur culture, ainsi que des problèmes liés à leur conservation.
En effet, des recherches ont montré que, quelle que soit la rapidité avec laquelle les tissus cérébraux sont congelés, le passage de la congélation à la décongélation provoque toujours des lésions tissulaires. La conservation d’organoïdes cérébraux présentant des caractéristiques pathologiques spécifiques par le biais de la congélation est extrêmement difficile, car très peu de neurones restent fonctionnels après décongélation. De ce fait, une grande partie des recherches sont effectuées immédiatement après l’obtention des échantillons de tissu.
D’un autre côté, les technologies de cryogénisation permettent désormais de conserver efficacement des cellules souches embryonnaires, des gamètes et des embryons. Après cryoconservation et décongélation, le sperme de bovin peut par exemple être fécondé in vitro. Après transplantation chez une femelle, les embryons obtenus se développent avec succès.
Cependant, la cryogénisation d’organoïdes cérébraux présentant une cytoarchitecture complexe se heurte à des défis de taille. En effet, les techniques utilisées pour les ensembles bidimensionnels de cellules et les organoïdes non neuraux, ne sont pas adaptées à ceux neuraux et aux tissus cérébraux humains vivants en général (en raison de leur architecture hautement complexe).
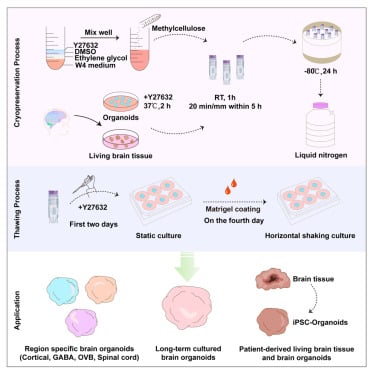
Des chercheurs de l’Université de Fudan, en Chine, ont développé un moyen de contourner ces problèmes en pré-trempant des organoïdes cérébraux dans une solution spéciale avant de les cryogéniser. La nouvelle technique a permis de conserver des amas corticaux volumineux et diversifiés qui ont conservé leur intégrité structurelle et leur fonction, même après un temps de cryogénisation étonnamment long.
Une croissance continue pendant 150 jours
Afin de développer leur solution de conservation, les chercheurs de l’Université de Fudan ont testé diverses combinaisons chimiques. Les ingrédients ont été sélectionnés selon leur capacité à maintenir après décongélation l’intégrité morphologique des organoïdes, à réduire la perte de cellules neurales et à favoriser la croissance des neurites (les projections du corps cellulaire d’un neurone : soit un axone, soit une dendrite). Parmi ces ingrédients figurent la méthylcellulose, l’éthylène glycol, la polyvinylpyrrolidone (PVP), le tréhalose, le glucose, le saccharose et la proline.
Les organoïdes cérébraux ont été cultivés pendant 21 jours à partir de cellules souches embryonnaires humaines. Ce temps de croissance permet à ces dernières de se différencier en cellules progénitrices neurales et en neurones fonctionnels. Après avoir été immergés dans une gamme de combinaisons de solution de conservation, les organoïdes obtenus ont été cryogénisés dans de l’azote liquide pendant 24 heures puis décongelés rapidement à l’eau tiède. Après de nombreuses tentatives et cycles de congélation-décongélation, les experts ont constaté que la combinaison la plus efficace est l’éthylène glycol, le méthylcellulose, le DMSO et le Y27632 (MEDY).
La seconde partie de l’étude consistait à évaluer l’efficacité de la solution MEDY sur différents types d’organoïdes spécifiques à diverses régions du système nerveux central, notamment le cerveau antérieur dorsal et ventral, la moelle épinière et la vésicule optique (OVB). L’âge des organoïdes (de 4 semaines à 3 mois) et la durée pendant laquelle ils ont été prétremprés dans la solution ont également été variés. La technique a en outre été testée sur des organoïdes dérivés de patients épileptiques.
Les chercheurs ont constaté qu’après chaque cycle de cryogénisation-décongélation, les organoïdes présentaient toujours des fonctions similaires à ceux qui n’avaient jamais été congelés. Les amas de cellules ont repris correctement leurs fonctions, même en étant décongelés après 18 mois, et ont continué leur croissance pendant environ 150 jours.
Par ailleurs, les organoïdes dérivés des patients épileptiques présentaient toujours les mêmes caractéristiques pathologiques après décongélation. Les analyses transcriptomiques ont montré que la solution a permis de conserver les fonctions synaptiques et inhiber la voie d’apoptose médiée par le réticulum endoplasmique.
L’équipe de recherche estime que la technique pourrait être étendue à des échantillons cérébraux plus volumineux, ce qui pourrait potentiellement constituer une aubaine pour les recherches dans le domaine. « MEDY permettra le stockage fiable et à grande échelle de divers organoïdes neuraux et de tissus cérébraux vivants et facilitera une recherche de grande envergure, des applications médicales et le développement de médicaments », concluent les chercheurs dans leur rapport, détaillé dans la revue Cell Reports Methods.