Des chercheurs proposent une nouvelle thérapie cellulaire pour traiter les maladies métaboliques, telles que le diabète de type 2 ou l’obésité. Basée sur la méthode CRISPR — des ciseaux moléculaires qui permettent de modifier le génome —, leur thérapie vise à transformer des cellules graisseuses standards en un autre type de cellules, des cellules de graisse brune, capables de brûler du glucose.
Testée avec succès sur les souris, cette approche constitue une nouvelle piste de traitement pour les personnes souffrant de maladies métaboliques associées au métabolisme des glucides. Un nouvel espoir pour les plus de 400 millions de personnes qui souffrent aujourd’hui de diabète dans le monde.
Des graisses qui brûlent de l’énergie
Le tissu adipeux est le plus grand réservoir d’énergie du corps humain ; il se compose de plusieurs types de cellules graisseuses (ou adipocytes) : les cellules de graisse blanche, de graisse brune et de graisse beige. Les adipocytes blancs, qui stockent les lipides, sont les plus nombreux (ils constituent près de 95% de notre tissu adipeux). Les adipocytes bruns et beiges sont moins abondants ; ils expriment la protéine découplante mitochondriale UCP1 (ou thermogénine) — responsable de la production de chaleur dans l’organisme — et sécrètent des substances utiles au bon fonctionnement du métabolisme.
La graisse est donc indispensable à l’organisme pour être en bonne santé, mais un surplus de graisse peut en revanche s’avérer rapidement néfaste. L’obésité et le diabète de type 2 sont des maladies associées à une mauvaise réponse tissulaire à l’insuline, à des perturbations des flux glucidiques et lipidiques, ainsi qu’à des comorbidités telles que la stéatohépatite non alcoolique (NASH) et les maladies cardiovasculaires. Pour traiter ces pathologies, l’utilisation de cellules humaines comme agents thérapeutiques offre des avantages majeurs par rapport aux médicaments.
Les thérapies cellulaires sont d’ailleurs déjà utilisées dans le traitement de certaines formes de cancer (leucémie, lymphome, mélanome). Cette approche implique une modification génétique ex vivo de cellules immunitaires prélevées sur un sujet humain, pour améliorer leur capacité à perturber les tumeurs malignes lors de leur réinjection dans le même sujet. En théorie, cette stratégie devrait être efficace pour traiter les maladies dans lesquelles des cellules ayant un potentiel thérapeutique pertinent peuvent être génétiquement modifiées pour augmenter ce potentiel.
Or, des recherches récentes ont révélé que les adipocytes thermogéniques (graisse brune et beige) avaient un fort potentiel régulateur du métabolisme de l’organisme dans le cas des maladies métaboliques. Ainsi, des chercheurs ont suggéré que les conditions métaboliques liées à l’obésité pourraient être traitées en transformant la graisse blanche d’un individu, en graisse beige, via l’outil d’édition de gènes CRISPR. Les cellules graisseuses beiges ont en effet la particularité de brûler les calories plutôt que de les stocker. « Ce serait une thérapie personnalisée pour les maladies métaboliques », précise Silvia Corvera, biologiste moléculaire à la faculté de médecine de l’Université du Massachusetts, co-auteure de l’étude.
Une diminution significative du poids corporel
Concrètement, il s’agirait donc de modifier génétiquement les cellules graisseuses pour qu’elles évoluent en graisse beige. De nombreuses études ont démontré que l’implantation de tissu adipeux brun de souris chez des souris obèses et intolérantes au glucose peut améliorer leur tolérance au glucose et la sensibilité à l’insuline.
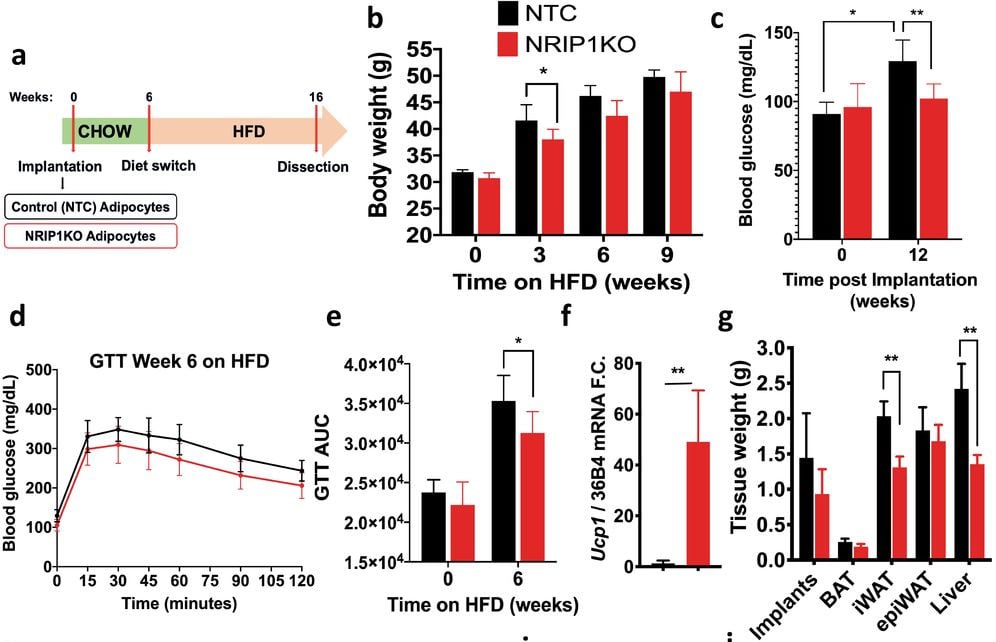
Pour améliorer le potentiel thérapeutique des adipocytes dans l’obésité et le diabète, les chercheurs ont ciblé particulièrement le gène Nrip1 de la souris. Il a en effet été démontré que ce gène supprime fortement le transport du glucose, l’oxydation des acides gras, la respiration mitochondriale, l’expression de la protéine découplante 1 (notée UCP1), ainsi que la sécrétion de certains facteurs métaboliquement bénéfiques, notamment la neuroréguline.
La désactivation de Nrip1 dans les adipocytes blancs — à l’aide de l’outil CRISPR — régule à la hausse les gènes qui sont fortement exprimés dans les adipocytes bruns, améliorant l’utilisation du glucose et des acides gras et générant de la chaleur. Si l’édition génomique CRISPR est une approche intéressante pour augmenter le taux de graisses beiges/brunes, un aspect clé de la stratégie de ciblage du gène Nrip1 était d’employer des méthodes qui élimineraient son expression dans les adipocytes, mais sans provoquer de réponse immunitaire lors de l’implantation des cellules. Il fallait en outre s’assurer de la stabilité à long terme des adipocytes génétiquement modifiés.
Les chercheurs ont donc mis au point des méthodes spécifiques permettant de pallier ces problèmes, en délivrant ex vivo des complexes protéiniques de Cas9 et de sgARN (ARN guide) dans les cellules précurseurs de graisse humaine ; ces cellules modifiées, qui ont donné naissance à des cellules adipeuses beiges ont été implantées chez des souris.
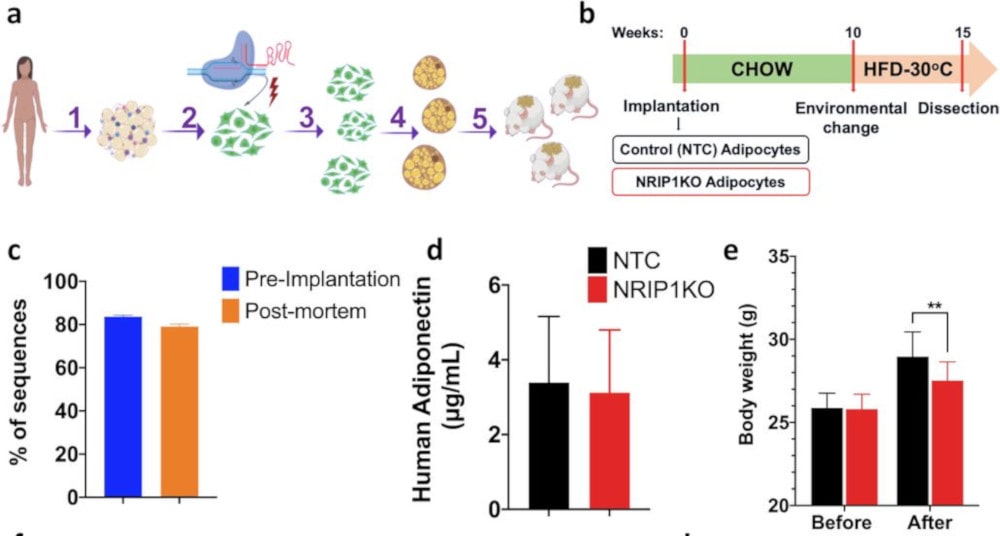


Lorsque ces souris ont été ensuite soumises à un régime particulièrement riche en graisses, celles qui ont bénéficié d’une implantation de graisse beige humaine ont affiché une perte de poids notable par rapport à celles qui ont reçu des cellules graisseuses humaines non modifiées. En outre, les rongeurs ayant reçu de la graisse beige ont continué à réguler leur glycémie normalement, tandis que les autres sont devenus intolérants au glucose.
Du point de vue des spécialistes, ces observations sont très encourageantes, d’autant plus que la thérapie serait relativement simple à mettre en place : « Environ un gramme de graisse d’une personne fournirait suffisamment de cellules précurseurs de graisse pour le traitement », précise Corvera. Leur méthode devrait être testée chez des primates non humains avant les premiers essais cliniques sur l’Homme.


