Il est temps de revoir tout ce que vous avez appris sur le carbone. Vous ne vous souvenez peut-être pas très bien de vos cours de chimie de l’école secondaire ou du lycée, mais vous vous rappelez probablement avoir appris quelque chose de fondamental à propos du carbone ? N’est-ce pas ? Laissez-nous vous rafraîchir la mémoire.
Tout d’abord, il s’agit de l’élément par excellence à la base de la vie, et il peut former des liens allant jusqu’à quatre liaisons avec d’autres molécules. Les quatre liaisons maximales du carbone sont responsables de la structure des diamants, du méthane et de l’alcool, pour ne nommer que quelques molécules.
Pourtant, un adolescent étudiant dans un lycée d’Oklahoma (États-Unis) a voulu mettre à l’épreuve cette limite théorique. Selon lui, le carbone peut former plus de liens qu’on ne l’aurait jamais pensé, rapporte-t-il dans une nouvelle étude qu’il a co-écrit avec son professeur de lycée, publiée jeudi dernier dans le Journal of Molecular Modeling.
L’ère des quatre liaisons semble être révolue, et ce grâce à un lycéen, qui plus est étudie dans l’un des pires États du pays en matière de soutien et de financement de l’éducation publique.
On peut dire que cette découverte sans précédent, est survenue grâce aux talents et à la passion de George Wang, étudiant à l’Oklahoma School of Science and Mathematics d’Oklahoma City. Son professeur de chimie, Dr. A.K. Fazlur Rahman, donnait des conférences sur les quatre liaisons standard du carbone, quand il a présenté un article publié en 2016 par des scientifiques allemands, démontrant que le carbone pouvait dans des situations très spécifiques, avoir jusqu’à 6 liaisons. « J’ai demandé aux étudiants : est-il possible qu’il y en ait plus que six ?« , déclare Rahman, chimiste organique de formation.
Et Wang a relevé le défi, en démontrant que le carbone peut avoir non seulement six mais étonnamment, sept liaisons. Quand Wang a fait part de son hypothèse au professeur Rahman, ce dernier lui a simplement dit « Intéressant, mais j’ai besoin de voir tes calculs« . Ces modèles et calculs sont maintenant publiés dans une revue internationale de chimie, et l’étude est en attente de révision par les pairs.
Wang a d’ailleurs dit qu’il avait déjà appris à utiliser la méthode de modélisation d’atome VASP avant de faire ce genre d’expérimentation, notamment grâce à l’aide de guides d’utilisation en ligne. Décrit comme un « véritable auto-didacte » par son professeur, Wang explique modestement son talent : « Je suis passionné de chimie depuis l’école primaire, et je lis un tas de livres de chimie« .

La raison pour laquelle nous considérons le carbone comme étant « tétravalent », est qu’il possède une valence chimique de 4 (quatre électrons libres dans sa couche externe), donc la capacité de créer jusqu’à quatre liaisons. Selon la « règle de l’octet » fondamentale de la chimie, les atomes ont besoin de huit électrons dans leurs enveloppes externes pour être stables.
Une façon dont un atome peut remplir cette règle est d’associer ses électrons libres à ceux d’un autre atome. Donc, si chacun des quatre électrons libres du carbone forme une paire avec celui d’un autre atome, l’atome de carbone aura alors quatre liaisons – et huit électrons stables. La théorie de la nature « tétravalente » du carbone est un pilier de la chimie organique.
Mais il y a des exceptions. Il est en effet possible d’obtenir ce que l’on appelle un « hypercarbone », caractérisé par sa capacité à lier plus que les quatre atomes habituels. Dans les années 1950, il a été montré qu’il était possible de former jusqu’à cinq liaisons. Puis en 2016, une équipe allemande a réussi à obtenir jusqu’à six liaisons, dans des circonstances particulières.

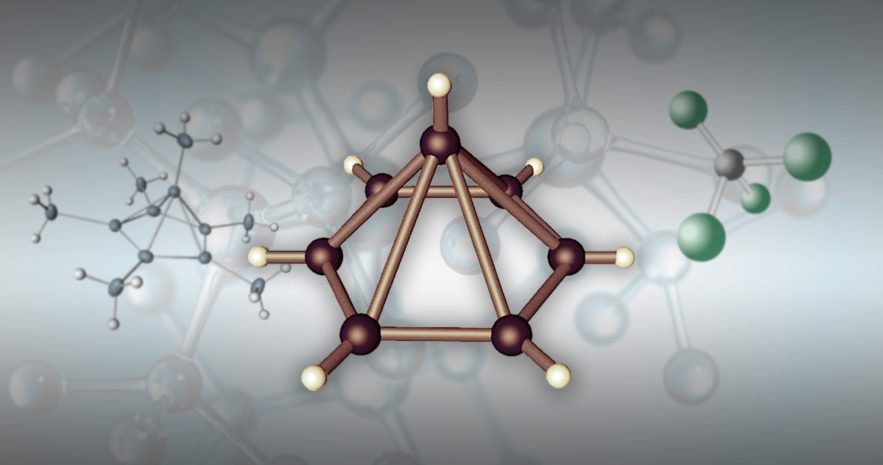
Wang et Rahman, en collaboration avec Bin Wang, un chimiste de l’Université d’Oklahoma, montrent dans le cadre de cette nouvelle recherche, qu’il est possible que le carbone forme une liaison inédite avec sept liens, quand il est sous la forme de « ion tropylium ». Plus que de simples anomalies fascinantes, les hypercarbones comme celui-ci ont « des applications potentielles dans la synthèse chimique et dans le stockage de l’hydrogène« , spécifient Wang et ses co-auteurs.
Les calculs de densité des chercheurs montrent une configuration hexagonale-pyramidale 3D stable du tri-cation de tropylium, C7H73+, dans laquelle un atome de carbone heptacoordiné est impliqué. Ils ont démontré que cette configuration était stable contre la déprotonation (une réaction chimique au cours de laquelle un proton H+ est retiré d’une molécule), contre la dissociation et la déformation structurelle.
Cette découverte est remarquable pour plusieurs raisons. Premièrement, car elle a été faite par un jeune lycéen. Deuxièmement, car l’histoire de cette dernière est étrangement similaire à une autre découverte ayant été faite plus tôt dans l’histoire de la chimie du carbone, quand Jacobus Henricus van’t Hoff, Jr., âgé alors de 22 ans, a montré en 1874 que le carbone n’était pas planaire, mais plutôt une molécule tridimensionnelle.
Aujourd’hui, George Wang est déjà au travail sur un problème de synthèse organique – une autre énigme que lui propose Rahman – qui devrait occuper son intellect jusqu’à ce qu’il débute ses études universitaires, plus tard cette année. Il a été accepté à l’Université de Stanford pour le semestre d’automne 2018, où il étudiera la chimie, bien entendu. Et on ne lui souhaite que du succès !

 L’électron est une particule élémentaire qui, avec les protons et les neutrons, constitue les atomes. C’est donc l’un des composants principaux de la matière baryonique. À ce titre, il revêt... [...]
L’électron est une particule élémentaire qui, avec les protons et les neutrons, constitue les atomes. C’est donc l’un des composants principaux de la matière baryonique. À ce titre, il revêt... [...]