Des chercheurs ont développé une nouvelle technique de bioimpression 3D consistant à introduire une bioencre chargée de cellules cardiaques dans un gel auto-cicatrisant servant d’échafaudage. Le dispositif a permis de surmonter l’un des plus grands défis de l’ingénierie tissulaire, en produisant des ventricules quasi fonctionnels capables de battre durant plus de 3 mois de façon autonome.
L’ingénierie tissulaire permet de concevoir des structures biologiques largement utilisées dans la médecine régénérative. Cependant, avant l’avènement de la bioimpression 3D, les technologies disponibles ne permettaient de produire que des structures relativement simples. En effet, les tissus cardiaques artificiels par exemple, sont produits en coulant dans un support un mélange de protéines de la matrice extracellulaire (ECM), de cardiomyocytes et d’autres types de cellules cardiaques.
Cette technique permet de produire des structures à géométries simplifiées telles que des filaments, des anneaux ou des grilles. Des ventricules en forme de ballon ont également été générés à l’aide de moules spéciaux ou en intégrant de la bioencre chargée de cellules dans des échafaudages solides pré-imprimés en 3D.
Cependant, ces techniques comportaient des limites dans la mesure où elles ne peuvent pas générer des tissus avec des arrangements multicellulaires complexes. Et bien que les technologies de bioimpression 3D permettent aujourd’hui d’élaborer des structures beaucoup plus complexes, elles sont encore confrontées à un certain nombre de défis.
Surmonter un défi majeur de la bio-impression 3D
Dans notre organisme, la majorité des tissus ou organes assurent des fonctions d’une grande complexité, que les technologies de bioimpression 3D actuelles ne parviennent pas à reproduire fidèlement. Le tissu cardiaque figure parmi ces structures, les cellules le composant étant dotées d’un mécanisme de contraction autonome. Au sein du cœur, ces cellules battent à l’unisson selon un rythme très précis, afin d’irriguer l’ensemble de l’organisme.
Cette contractilité doit être également répartie rythmiquement à travers un réseau de cavités (les ventricules et les oreillettes) et s’effectue par le biais de canaux ioniques (régissant l’homéostasie calcique, potassique, etc.). La reproduction en laboratoire de cet agencement tissulaire complexe, capable de s’activer de manière autonome au sein d’un organe entier, constitue l’un des plus grands défis de la bioimpression 3D.
Les dernières techniques sont parvenues à générer des organes miniaturisés comprenant les cavités et les vaisseaux principaux. Pour ce faire, des cardiomyocytes dérivés de cellules souches pluripotentes induites par l’homme (hiPSC-CM) et incorporés dans une matrice produite à partir de l’épiploon (membrane tapissant les parois de l’abdomen et qui recouvre et soutient les organes) ont été directement imprimés. Cependant, malgré la prouesse structurelle, aucune activité électrique ou contractilité n’a pu être établie.
Antérieurement, des chercheurs ont réussi à établir cette activité électrique en adoptant un type de bio-encre pour la création d’hydrogels mous. Bien que la structure obtenue comprenait des réseaux interconnectés de cellules cardiaques — capables de se contracter spontanément —, la complexité géométrique pouvant être obtenue était relativement limitée.
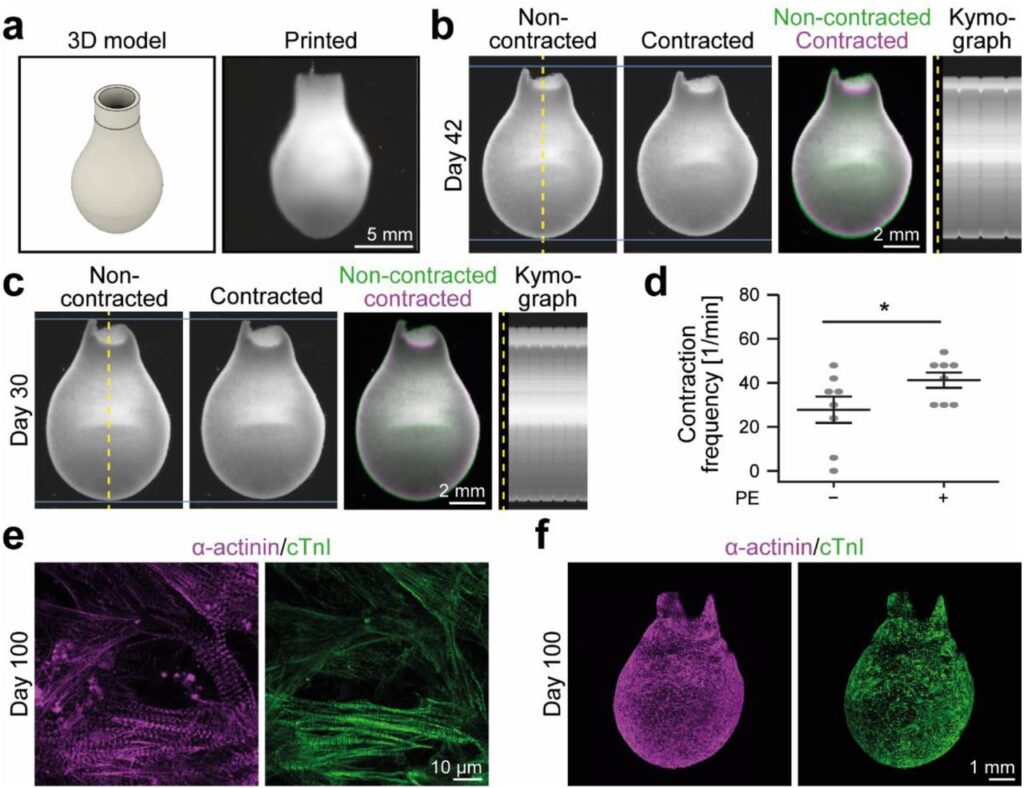
Une nouvelle étude, disponible en prépublication sur bioRxiv, suggère de surmonter certains de ces défis en développant une technologie d’impression directe de hiPSC-CM. Ceci afin d’obtenir un agencement fonctionnel de tissus cardiaques. Un nouveau dispositif résultant de ces efforts, conçu par des chercheurs de l’Université Friedrich-Alexander d’Erlangen à Nuremberg, a permis de produire des structures allant de simples anneaux à de véritables ventricules miniatures se contractant spontanément pendant plus de 100 jours consécutifs. La force de contraction pourrait d’ailleurs être ajustée par le biais de stimuli pharmacologiques.
Un procédé d’impression dans un gel
Le protocole des chercheurs comporte une solution pré-gélifiée de collagène pouvant être imprimée au sein d’un bain composé d’un second gel servant de support. En effet, étant l’une des protéines les plus abondantes dans le cœur, le collagène est hautement compatible avec l’ingénierie tissulaire cardiaque. Toutefois, les hydrogels de collagène sont particulièrement difficiles à imprimer, une fois gélifiés.
Dans leur procédé d’impression dit « impression dans un gel (in-gel) », ils contournent cet obstacle en se servant du bain de support en tant que stabilisateur. Plus précisément, cette technique permet à l’hydrogel (la bioencre) de conserver suffisamment longtemps sa forme liquide pour que la buse d’impression puisse traverser le bain de support.
Afin d’imprimer des hiPSC-CM dans des formes complexes, les chercheurs ont préalablement développé un bain de support composé de microparticules de gélatine et de gomme arabique. Lorsque ces microparticules sont compactées par centrifugation, elles forment un support auto-cicatrisant, permettant à une buse d’impression de le traverser sans dommages tout en stabilisant l’ensemble de la structure. La bioencre — un mélange de collagène pré-gélifié et d’acide hyaluronique contenant les cellules — est injectée à l’intérieur de ce support pour imprimer la forme souhaitée. Une fois l’impression achevée, le gel de bain de support est dissous pour ne laisser que la structure finale.
Grâce à ce protocole, les chercheurs ont obtenu une structure en forme de ballon capable de se contracter de façon autonome. Le ventricule artificiel mesure 14 millilitres de haut et la base fait environ 8 millimètres de diamètre. En comparaison, les ventricules d’un cœur humain moyen sont six fois plus grands.
Prochainement, les chercheurs envisagent de transposer le protocole à un cœur entier doté de deux ventricules et de deux oreillettes contractiles. Néanmoins, cet objectif comporte également d’autres défis : par exemple, étant donné que le myocarde comporte également un grand nombre de vaisseaux sanguins (sans compter les vaisseaux coronaires) et de nerfs, d’autres types de bioencres seront nécessaires pour la conception d’un organe véritablement fonctionnel. Là encore, l’interfonctionnalité des différents tissus devra être éprouvée.


