Un peptide développé par des chercheurs japonais a inversé le déclin cognitif chez des modèles murins d’Alzheimer, en rétablissant les fonctions synaptiques. Administré par voie nasale, le traitement cible la dynamine, une protéine essentielle à la capacité des vésicules synaptiques à transporter les neurotransmetteurs. Suite au traitement, leurs résultats cognitifs étaient comparables à ceux des souris saines.
Alzheimer est une maladie neurodégénérative progressive se manifestant par un déclin cognitif, une perte de mémoire et à terme, l’incapacité à accomplir les tâches quotidiennes les plus simples. Affectant près de 55 millions de personnes dans le monde, sa prévalence pourrait doubler d’ici 2060 en raison du vieillissement de la population.
Cependant, bien qu’il s’agisse de la forme de démence la plus courante, ses mécanismes physiopathologiques demeurent en grande partie incompris, ce qui entrave considérablement la recherche de traitements. Les thérapies disponibles à ce jour ne guérissent pas la maladie, mais en ralentissent uniquement (légèrement) la progression. D’autre part, en raison de sa nature évolutive, il est souvent trop tard pour intervenir une fois que les symptômes cognitifs commencent à apparaître. La recherche thérapeutique se concentre ainsi principalement sur les stratégies d’intervention précoce.
Restaurer les fonctions des vésicules synaptiques
Parmi les principales caractéristiques d’Alzheimer figurent l’enchevêtrement neurofibrillaire induit par l’augmentation de la protéine tau phosphorylée. Parallèlement, les niveaux de la protéine sous sa forme soluble augmentent également. En temps normal, les protéines tau stabilisent la structure des microtubules (les fibres constituant le cytosquelette) au niveau des axones. Cependant, elles commencent à se dissocier de ceux-ci à mesure que la maladie progresse. Des monomères solubles de la protéine s’accumulent ainsi au niveau des compartiments synaptiques, ce qui, à son tour, accélère l’enchevêtrement neurofibrillaire et in fine la destruction des synapses.
Des études ont montré que le dysfonctionnement synaptique induit par l’augmentation de la protéine tau soluble survient plusieurs mois avant l’enchevêtrement neurofibrillaire. Cela est principalement dû à l’altération de la fonction d’endocytose des vésicules synaptiques par l’accumulation de la protéine. En d’autres termes, les protéines tau solubles entravent la capacité de ces vésicules à transporter correctement les neurotransmetteurs entre les synapses.
Plus précisément, les vésicules synaptiques enveloppent (endocytose) et transportent les neurotransmetteurs depuis l’intérieur de la synapse vers la fente synaptique, au niveau de laquelle la cargaison neurochimique est libérée (exocytose). Ces vésicules doivent être constamment recyclées afin d’assurer un approvisionnement permanent en neurotransmetteurs. L’endocytose est régulée par une protéine appelée « dynamine », qui détache les vésicules de la membrane synaptique au cours du recyclage. Cette protéine est à la fois disponible sous une forme libre et sous une forme liée aux microtubules.
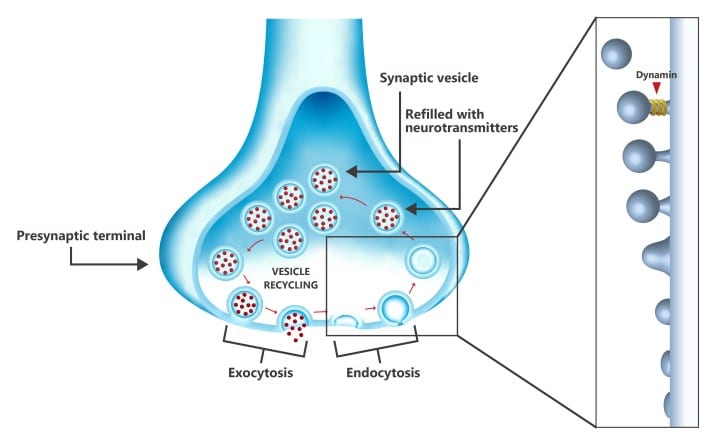
Or, au stade précoce d’Alzheimer, l’augmentation de la protéine tau soluble provoque une surabondance de microtubules. Ces derniers accaparent de manière excessive la dynamine intrasynaptique, ce qui réduit sa disponibilité pour l’endocytose vésiculaire. Des chercheurs de l’Institut des sciences et technologies d’Okinawa (OIST) ont alors supposé que l’inhibition de l’interaction entre la dynamine et les microtubules pourrait empêcher le déclin cognitif lié à Alzheimer, avant que les synapses ne soient endommagées de manière irréversible. Leurs résultats sont décrits dans la revue spécialisée Brain Research.
Des résultats cognitifs comparables à ceux des souris saines
Pour explorer leur hypothèse, les chercheurs ont sélectionné des souris transgéniques souffrant d’Alzheimer (maladie induite). Afin d’inhiber l’interaction de la dynamine avec les microtubules, ils ont développé un petit peptide appelé PHDP5. « En empêchant l’interaction entre la dynamine et les microtubules, PHDP5 garantit qu’elle est disponible pour l’endocytose des vésicules pendant le recyclage, ce qui peut restaurer la communication perdue entre les neurones à un stade précoce de la maladie », explique dans un communiqué de l’OIST Zacharie Taoufiq, coauteur principal de l’étude.
D’autre part, les chercheurs ont modifié la séquence du peptide de sorte qu’il puisse pénétrer facilement à l’intérieur des cellules. Cela a permis au traitement d’être administré par voie nasale, qui débouche au niveau d’une région où la barrière hématoencéphalique est plus fine et proche de l’hippocampe (la région cérébrale responsable de la mémoire). Avec cette technique, le médicament est délivré de manière plus ciblée et à une concentration plus élevée au niveau de l’hippocampe, par rapport aux autres traitements. Cette alternative permet également de minimiser les effets secondaires potentiels associés au passage à travers d’autres organes.
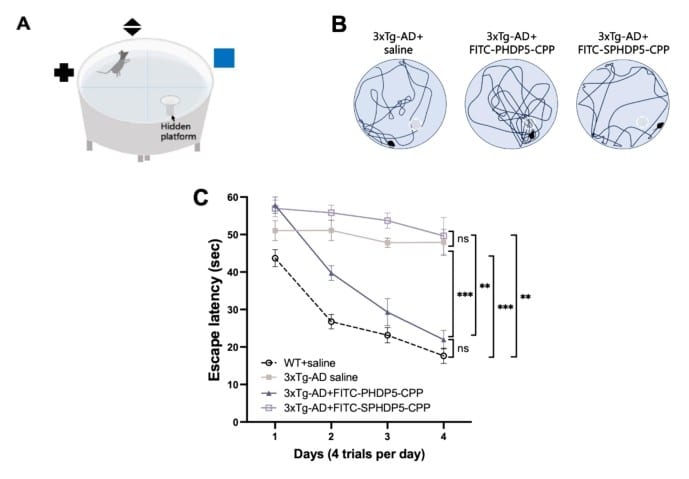


Il a été constaté que le médicament réduisait de manière significative l’interaction dynamine-microtubule, ce qui a conduit à une inversion efficace du déclin cognitif chez les souris (testé par le biais d’un système de labyrinthe). Cette réduction était telle que la capacité d’apprentissage et la mémoire de ces dernières étaient comparables à celles des souris saines. Bien que le traitement ne guérit pas la maladie de manière définitive, « ce succès met en évidence le potentiel du ciblage de l’interaction dynamine-microtubule en tant que stratégie thérapeutique pour la maladie d’Alzheimer », estime Chia-Jung Chang, auteur principal de la recherche. Elle pourrait d’ailleurs être transposée à d’autres tauopathies.
La prochaine étape de la recherche consiste au passage aux essais cliniques, qui seraient mieux prix en charge par des entreprises pharmaceutiques, selon les chercheurs. Alors que le développement d’un médicament standard peut prendre plus d’une décennie, « nous espérons vivement que notre peptide pourra passer les tests et atteindre les patients sans trop tarder », conclut Tomoyuki Takahashi, qui a dirigé l’étude.