La recherche de nouveaux traitements visant à combattre la redoutable maladie d’Alzheimer a pris un nouvel élan ces dernières années. Et parfois, la nature y apporte ses propres indices. En 2016, des chercheurs de Harvard ont analysé le cerveau et le sang d’une femme de Medellín (Colombie) âgée de 73 ans, qui portait une mutation génétique ayant amené de nombreux membres de sa famille à développer une démence à un âge avancé. Mais pendant des décennies, elle, avait naturellement évité la maladie. Les chercheurs ont donc essayé de comprendre comment cela était possible. Dans une nouvelle étude, ils rapportent qu’une autre mutation rare (bien connue comme étant un facteur de risque pour la maladie d’Alzheimer), celle du gène de l’APOE, peut aussi l’avoir protégée.
Bien que les chercheurs ne puissent pas prouver que cette mutation seule ait permis d’éviter la maladie, leur étude attire à nouveau l’attention sur la possibilité de prévenir ou traiter la maladie d’Alzheimer en ciblant le gène de la protéine APOE. Une idée qui, selon certains chercheurs, a déjà passé trop de temps sous les projecteurs.
« Ce cas est très spécial », déclare Yadong Huang, neuroscientifique aux Gladstone Institutes de San Francisco, en Californie, qui n’a pas participé à la recherche. « Cela pourrait ouvrir une nouvelle voie très prometteuse tant en recherche qu’en thérapie ».
Le gène de l’APOE, le facteur de risque génétique le plus puissant pour la maladie d’Alzheimer, existe sous trois formes communes (allèles). Une variante appelée APOE2 réduit le risque de la maladie. La variante la plus commune, APOE3, n’influence pas le risque. APOE4 (allèle 4) quant à lui, augmente le risque ; environ la moitié des personnes atteintes par la maladie ont au moins un exemplaire de cette variante.
Les chercheurs envisagent depuis longtemps de cibler APOE avec des thérapies. Dans ce but, une équipe de l’Université Cornell va bientôt commencer un essai clinique visant à « infuser » le gène protecteur APOE2 dans le liquide céphalo-rachidien de personnes présentant deux copies d’APOE4.
Protéine APOE : des gènes encore trop peu compris
Cependant, de nombreuses questions restées sans réponse concernant APOE l’ont empêchée de devenir une cible prioritaire des médicaments. La protéine APOE se lie et transporte les graisses et est abondante dans le cerveau. Mais « elle fait tellement de choses dans le cerveau que ça en est déroutant », déclare Eric Reiman, neuroscientifique au Banner Alzheimer’s Institute de Phoenix et co-auteur de la nouvelle étude, publiée dans la revue Nature Medicine.
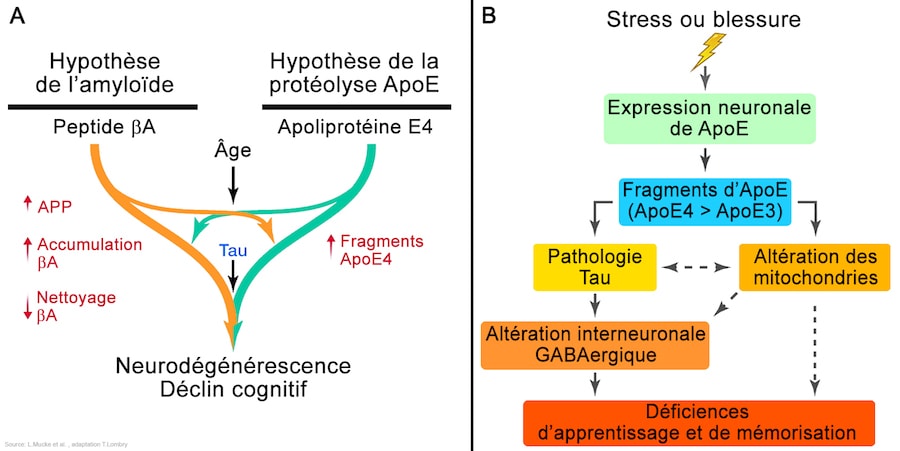
APOE4 semble favoriser la formation de plaques collantes de la protéine bêta-amyloïde, qui obstrue le cerveau dans le cas d’Alzheimer. Mais les puissants médicaments anti-amyloïdes n’ont en grande partie pas profité aux patients participant aux essais cliniques. Certains chercheurs n’ont trouvé aucune raison d’essayer une thérapie ciblée sur APOE, qui semblait juste être « un traitement antiamyloïde pour les pauvres », déclare Reiman.
Un cas particulier qui pourrait tout changer concernant APOE
Mais le cas de la femme colombienne (l’équipe de recherche garde son nom confidentiel) suggère d’autres moyens dont APOE peut affecter le risque de développer la maladie d’Alzheimer. La femme en question a participé à une étude menée par des chercheurs de l’Université d’Antioquia à Medellín, qui a permis de suivre environ 6000 membres de sa famille élargie.
Il résulte qu’environ un cinquième d’entre eux portaient une mutation causant la maladie d’Alzheimer, dans un gène d’une protéine appelée Préséniline 1 ; ces porteurs ont généralement développé une démence à la fin de la quarantaine. Pourtant, la femme n’a pas montré les premiers signes de la maladie avant ses 70 ans, alors même qu’elle portait la mutation. « C’est vraiment un cas particulier », déclare le biologiste cellulaire Joseph Arboleda-Velasquez, de la faculté de médecine de Harvard, à Boston.
À Harvard, une tomographie à émission de positrons du cerveau de la femme a révélé une accumulation d’amyloïde plus importante que chez tout autre membre de la famille scanné. « C’était très frappant », déclare Yakeel Quiroz, neuropsychologue clinique au Massachusetts General Hospital et à la Harvard Medical School.
Cependant, l’équipe n’a trouvé aucun signe de lésion majeure des neurones et l’accumulation minimale d’une autre caractéristique de la maladie d’Alzheimer : la protéine tau mal repliée.
Quelle que soit la protection dont disposait cette femme, elle ne dépendait pas du fait que le cerveau soit exempt d’amyloïde. Son cas plaide plutôt pour l’idée que tau joue un « rôle crucial dans les manifestations cliniques de la maladie d’Alzheimer », déclare Jennifer Yokoyama, neurogénéticienne à l’Université de Californie à San Francisco.
Une mutation rare dans le gène de l’APOE
Un séquençage du génome a révélé deux copies d’une mutation rare dans le gène APOE. Découverte pour la première fois en 1987, la mutation, connue sous le nom de « mutation de Christchurch », se produit dans une région distincte de celles qui déterminent le statut d’APOE2, 3, ou 4 d’une personne donnée. La femme colombienne portait la variante neutre, APOE3.
Des recherches antérieures avaient révélé que la mutation de Christchurch, comme la mutation APOE2, altère la capacité d’APOE à se lier et à éliminer les graisses, ce qui conduit parfois à une maladie cardiovasculaire.
Les chercheurs ont également découvert que cette mutation empêchait APOE de se lier fortement à d’autres molécules appelées protéoglycanes à héparane sulfate (HSPG), qui recouvrent les neurones et d’autres cellules « comme un tapis », explique Guojun Bu, neuroscientifique à la Mayo Clinic de Jacksonville, en Floride, qui a étudié l’interaction entre ces molécules et APOE.
Sur le même sujet : Un essai clinique inverse une année d’effets de la maladie d’Alzheimer en seulement 2 mois
APOE2 peut également nuire à la capacité de la protéine à se lier aux HSPG. Mais la façon dont ce mécanisme permet de protéger contre la maladie n’est pas clair. Un indice probable : les recherches du neuroscientifique Marc Diamond et ses collègues, du centre médical Southwestern de l’Université du Texas à Dallas, suggèrent que la protéine tau toxique s’appuie sur les HSPG pour favoriser sa propagation entre les cellules. Peut-être que moins l’APOE est liée aux HSPG, plus il est difficile pour tau de se propager.
Cependant, davantage d’études seront nécessaires pour comprendre si cette relation existe, prévient Diamond. La mutation de Christchurch pourrait avoir des effets protecteurs sans rapport avec les HSPG. Il est également possible que d’autres mutations génétiques (que Christchurch) aient protégé la femme.
Si les entraves à la liaison normale de l’APOE l’avaient vraiment épargnée de la maladie d’Alzheimer, les traitements futurs pourraient viser à imiter cet effet. Un anticorps ou une petite molécule pourrait s’accrocher à la protéine APOE pour interférer avec la liaison ; l’édition de gènes pourrait changer la structure de l’APOE pour imiter la mutation de Christchurch. Ou alors, une approche par « silençage de gènes » pourrait réduire la production d’APOE.
Reiman espère que la nouvelle étude ralliera les chercheurs à la poursuite de traitements liés à APOE. Quiroz, Arboleda-Velasquez et d’autres collaborateurs ont également publié le 2 novembre un article (en préimpression) montrant que les personnes munies de deux copies d’APOE2 ont un risque bien plus faible de développer Alzheimer que précédemment estimé (environ 99% de moins que les personnes ayant deux copies d’APOE4).
« Lorsqu’il s’agit de trouver un traitement qui pourrait avoir un impact profond sur la maladie, APOE peut être parmi les cibles les plus évidentes » conclut Reiman.