Un essai clinique visant à évaluer l’innocuité et l’efficacité de l’antiviral expérimental Remdesivir chez des adultes hospitalisés diagnostiqués avec le COVID-19, a commencé à l’University of Nebraska Medical Center (UNMC). Le directeur de l’essai est l’Institut national des allergies et des maladies infectieuses (NIAID), qui fait partie des National Institutes of Health (NIH). Il s’agit du premier essai clinique aux États-Unis à évaluer un traitement expérimental pour le COVID-19.
Le premier participant à l’essai est un Américain qui a été rapatrié après avoir été mis en quarantaine sur le bateau de croisière Diamond Princess, qui a accosté à Yokohama, au Japon, et s’est porté volontaire pour participer à l’étude. La recherche peut être adaptée pour évaluer des traitements d’investigation supplémentaires et pour inscrire des participants sur d’autres sites aux États-Unis et dans le monde.
La nécessité de développer un traitement rapide contre le COVID-19
Il n’existe pas de traitement thérapeutique spécifique approuvé par la Food and Drug Administration (FDA) pour traiter les personnes atteintes du COVID-19. L’infection peut provoquer une maladie respiratoire légère à sévère, et les symptômes peuvent inclure de la fièvre, de la toux et un essoufflement. Au 24 février, l’Organisation mondiale de la santé (OMS) avait signalé 77’262 cas confirmés de COVID-19 et 2595 décès en Chine, ainsi que 2069 cas et 23 décès dans 29 autres pays.
Selon les Centres pour le contrôle et la prévention des maladies (CDC), 14 cas confirmés de COVID-19 ont été signalés aux États-Unis et 39 autres cas parmi des personnes rapatriées aux États-Unis.
Le remdesivir, développé par Gilead Sciences Inc., est un traitement antiviral expérimental à large spectre. Il a déjà été testé chez l’Homme contre le virus Ebola et s’est révélé prometteur dans des modèles animaux pour le traitement du syndrome respiratoire du Moyen-Orient (MERS) et du syndrome respiratoire aigu sévère (SRAS). Des essais cliniques du remdesivir sont également en cours en Chine.
Remdesivir : un essai clinique sur l’Homme mené en double aveugle
Tous les participants potentiels subiront un examen physique de base avant de recevoir un traitement. Les participants à l’étude éligibles seront ensuite assignés au hasard soit au groupe de traitement expérimental, soit au groupe placebo. L’étude est en double aveugle, ce qui signifie que les investigateurs des essais et les participants ne savent pas qui reçoit du Remdesivir ou un placebo.
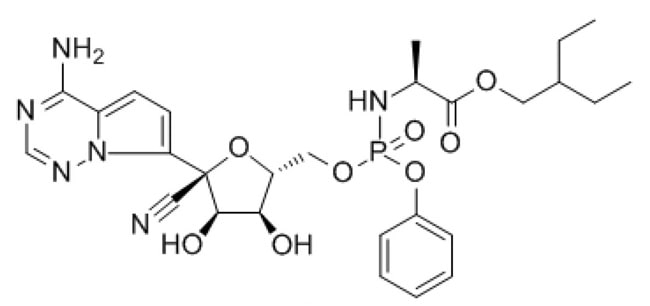
Les participants du groupe de traitement expérimental recevront 200 milligrammes (mg) de remdesivir par voie intraveineuse le premier jour de l’inscription à l’étude. Ils recevront encore 100 mg par jour pendant la durée de l’hospitalisation, pour un maximum de 10 jours. Le groupe placebo recevra, à volume égal, une solution qui ressemble au remdesivir mais qui ne contient que des ingrédients inactifs.
Sur le même sujet : Coronavirus 2019-nCoV : des chercheurs britanniques testent un vaccin expérimental sur la souris
Les cliniciens surveilleront régulièrement les participants et leur attribueront des scores quotidiens en fonction d’une échelle prédéfinie de résultats cliniques, qui tient compte, entre autres, de facteurs tels que la température, la pression artérielle et l’utilisation d’oxygène supplémentaire. Les participants seront également invités à fournir des échantillons de sang et des écouvillons du nez et de la gorge environ tous les deux jours. Les chercheurs vont tester ces spécimens pour le SRAS-CoV-2.
Initialement, les enquêteurs compareront les résultats des participants au jour 15 dans le groupe remdesivir et le groupe placebo pour voir si le médicament expérimental a augmenté le bénéfice clinique par rapport au placebo. Les résultats sont notés sur une échelle de sept points allant du rétablissement complet au décès. Les enquêteurs réévalueront cette échelle après avoir examiné les données des 100 premiers participants.