La transplantation d’organe, bien qu’elle permette de sauver des vies ou de rendre une vie normale à certains patients souffrant de maladies chroniques invalidantes, possède des inconvénients majeurs : un taux de réussite instable selon l’organe, la nécessité de suivre un traitement antirejet à vie (qui n’est pas sans effets secondaires), sans compter l’attente pour un donneur sain et compatible — qui peut parfois être fatalement longue. Pour pallier ce problème, l’espoir de la médecine repose sur le développement d’organes ultra-compatibles.
Dans cette idée, des chercheurs du Centre de recherche sur le génome humain et les cellules souches (HUG-CELL) de l’Institut des biosciences de l’Université de São Paulo (IB-USP), au Brésil, ont mis au point une technique permettant de reconstruire et de produire des foies en laboratoire. Les résultats ont été publiés dans la revue Materials Science and Engineering: C.
L’étude, servant de preuve de concept, a été réalisée avec des foies de rat. Dans une prochaine étape, les chercheurs adapteront la technique à la production de foies humains afin d’augmenter à l’avenir l’offre d’organes pour les transplantations. « L’objectif est de produire des foies humains en laboratoire. Cela évitera de devoir attendre longtemps un donneur compatible et réduira le risque de rejet de l’organe transplanté », a déclaré à la FAPESP Luiz Carlos de Caires-Júnior, auteur principal de l’étude.
Décellulariser pour recéllulariser : le « reconditionnement » des organes
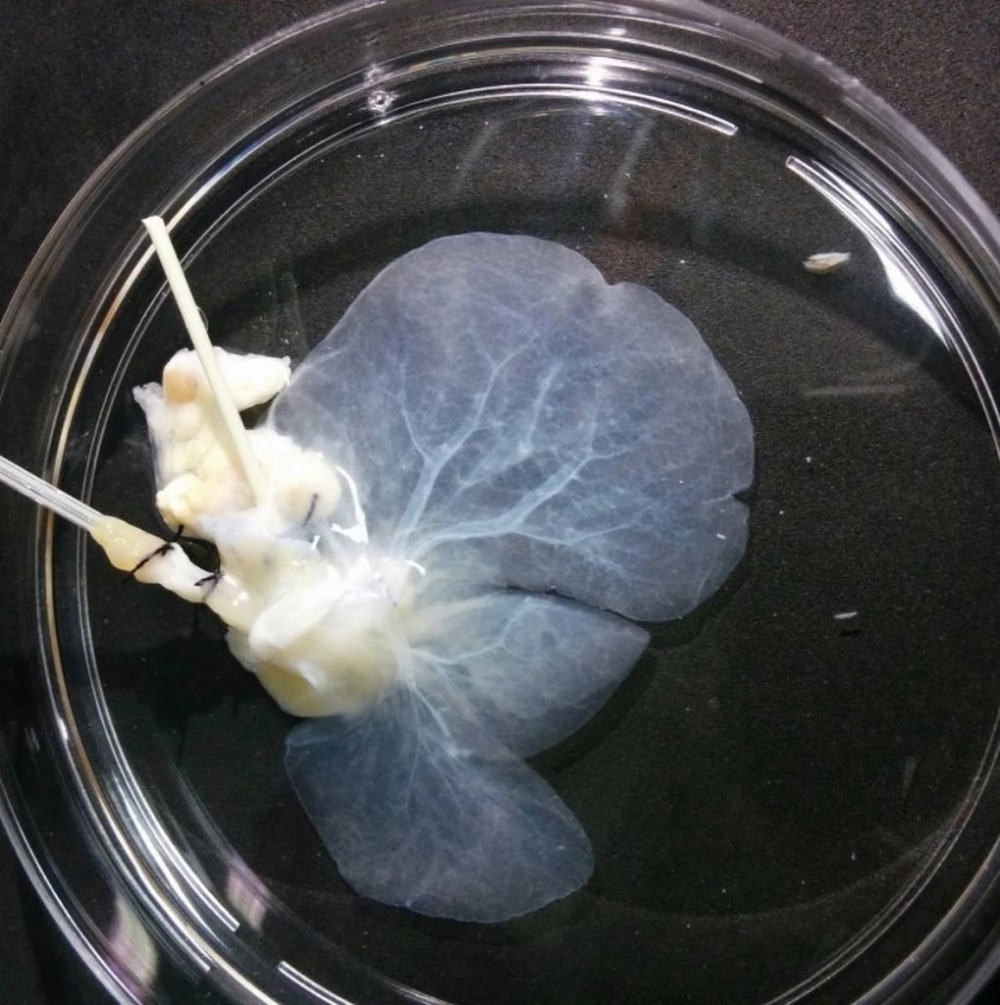
La méthode utilisée ici est basée sur la décellularisation et la recellularisation, des techniques de bio-ingénierie tissulaire développées ces dernières années pour produire des organes destinés à la transplantation. Un organe provenant d’un donneur décédé, dans ce cas le foie, serait traité avec différentes solutions contenant des détergents ou des enzymes pour éliminer toutes les cellules du tissu, ne laissant que la matrice extracellulaire avec la structure et la forme originales de l’organe. La matrice extracellulaire est ensuite ensemencée avec des cellules prélevées sur le patient. Cette technique permet d’éviter les réactions du système immunitaire et le risque de rejet à long terme.
« C’est comparable à la transplantation d’un foie « reconditionné ». Il ne sera pas rejeté parce qu’il utilise les propres cellules du patient, et il n’est pas nécessaire d’administrer des immunosuppresseurs », explique Mayana Zatz, chercheuse principale à l’HUG-CELL et co-auteure de l’étude.
La technique peut également être utilisée pour reconstituer des organes considérés initialement comme non transplantables, augmentant ainsi l’offre d’organes pour les patients sur la liste d’attente, explique Caires-Júnior. « De nombreux organes disponibles pour la transplantation ne peuvent en fait pas être utilisés parce que le donneur est décédé dans un accident de la route. La technique peut être utilisée pour les réparer, en fonction de leur état », a-t-il précisé.
Surmonter les obstacles de la décellularisation
Les chercheurs expliquent que le processus de décellularisation élimine toutefois les principaux composants de la matrice extracellulaire, comme les molécules qui indiquent aux cellules de se multiplier et de former des vaisseaux sanguins. Cela affaiblit l’adhésion des cellules à la matrice extracellulaire et compromet la recellularisation.
Pour surmonter cet obstacle, les chercheurs ont amélioré la technique en introduisant une étape supplémentaire entre la décellularisation et la recellularisation. Après avoir isolé et décellularisé des foies de rat, ils ont injecté dans la matrice extracellulaire une solution riche en molécules telles que SPARC et TGFB1 (entre autres), des protéines produites par des cellules hépatiques cultivées en laboratoire dans un milieu conditionné. Ces protéines sont essentielles à la bonne santé du foie, car elles indiquent aux cellules hépatiques de proliférer et de former des vaisseaux sanguins.
« L’enrichissement de la matrice extracellulaire avec ces molécules lui permet de devenir beaucoup plus semblable à celle d’un foie sain », déclare Caires-Júnior. Des matrices extracellulaires de foie de rat ont été traitées avec la solution, et des hépatocytes, des cellules endothéliales et des cellules mésenchymateuses, ont été introduits dans le matériau. Les cellules mésenchymateuses étaient dérivées de cellules souches pluripotentes induites (iPSC) humaines, produites par reprogrammation de cellules de peau adultes (ou de cellules provenant d’autres tissus facilement accessibles) dans un état pluripotent de type embryonnaire.
« L’étude montre qu’il est possible d’induire la différenciation de cellules souches humaines dans des lignées cellulaires du foie et d’utiliser ces cellules pour reconstruire l’organe de manière à ce qu’il soit fonctionnel. C’est une preuve de concept, la première démonstration que la technique fonctionne », déclare Zatz.
Les cellules hépatiques ont été injectées dans des matrices extracellulaires de foie de rat afin de produire un organe aux caractéristiques humaines. Celui-ci s’est développé pendant cinq semaines dans un incubateur qui simulait les conditions du corps humain. L’analyse a montré que l’enrichissement de la matrice extracellulaire avec SPARC et TGFB1 a considérablement amélioré la recellularisation. « Le traitement a permis aux cellules hépatiques de croître et de fonctionner plus vigoureusement », a déclaré Caires-Júnior. « Nous prévoyons de construire un bioréacteur pour décellulariser des foies humains et d’étudier la possibilité de les produire à l’échelle en laboratoire ». Caires-Júnior ajoute que la technique peut être adaptée pour produire d’autres organes, tels que des poumons, des cœurs et de la peau.
Adapter des organes d’animaux aux humains
Cette nouvelle étude fait partie d’un projet de grande envergure de l’HUG-CELL, visant à produire ou reconstruire des organes de transplantation par différentes techniques. Grâce à un projet mené en partenariat avec l’entreprise pharmaceutique EMS, les chercheurs de l’HUG-CELL visent à modifier des organes de porc tels que les reins, les cœurs et la peau, pour les transplanter chez l’Homme.
Étant donné certaines différences biologiques majeures, les foies de porc sont pour le moment rejetés lorsqu’ils sont transplantés chez l’Homme, c’est pourquoi les chercheurs poursuivent d’autres stratégies, comme l’impression 3D ainsi que, dans le cas de cette dernière étude par exemple, la décellularisation et la recellularisation. « Il s’agit d’approches complémentaires. Nous espérons voir des usines de transplantation d’organes à l’avenir », déclare Zatz.
Dans une dizaine d’années, à en croire les avancées dans ce domaine de recherche, il est donc fort probable que de véritables usines d’organes voient le jour. Une telle avancée résulterait non seulement en une augmentation du taux de disponibilité et de réussite pour les transplantations, mais également (probablement) d’une augmentation de la longévité pour les personnes fortunées, qui pourraient alors facilement acheter de nouveaux organes…