Des scientifiques de l’Institut de recherche Weill Cornell Medicine ont découvert qu’une mutation génétique liée à la maladie d’Alzheimer modifiait une voie de signalisation dans certaines cellules immunitaires des personnes atteintes de la maladie. Or, des essais réalisés sur des souris ont montré que le blocage de cette voie — à l’aide d’un médicament expérimental testé actuellement contre le cancer — semble ralentir, voire stopper le développement de la maladie. C’est un nouvel espoir de traitement contre cette maladie qui touche des millions de personnes dans le monde.
Les cellules immunitaires en question composent ce que l’on appelle la microglie ; ce sont des macrophages du système nerveux central qui constituent la principale ligne de défense immunitaire contre les agents pathogènes. Plusieurs études antérieures ont identifié de nombreuses mutations génétiques liées à la maladie d’Alzheimer qui sont fortement exprimées dans la microglie ; par conséquent, il est très probable que des altérations au sein de ces cellules jouent un rôle dans l’apparition et la progression de la maladie.
« La microglie est la gardienne du cerveau dans des conditions saines, mais peut devenir préjudiciable en cas de maladie. Notre objectif est d’identifier comment ces cellules deviennent toxiques et contribuent à la pathogenèse de la maladie d’Alzheimer », explique le Dr Li Gan, spécialiste en maladies neurodégénératives au Weill Cornell Medicine. Son équipe et elle ont notamment entrepris d’identifier des modulateurs immunitaires pouvant inverser la toxicité des cellules de la microglie sans diminuer leur fonction protectrice normale.
Un traitement qui repose sur l’inhibition d’une enzyme
La maladie d’Alzheimer est la maladie neurodégénérative la plus répandue chez les personnes âgées ; elle touche environ 46 millions de personnes dans le monde, dont près de 1,2 million en France. Selon le ministère des Solidarités et de la Santé, la maladie concerne 23% de la population après 80 ans. Les causes précises de la maladie ne sont pas encore clairement identifiées ; néanmoins, les théories suggèrent que des facteurs génétiques, environnementaux et liés au mode de vie jouent un rôle majeur dans l’apparition de la maladie, de même que des changements cérébraux liés à l’âge.
Ces dernières années de recherche ont permis de mieux comprendre les mécanismes mis en jeu : l’accumulation de protéines toxiques dans le cerveau (les peptides β-amyloïdes et la protéine Tau), ainsi que des changements au niveau du système immunitaire (mis en évidence lors d’études récentes), entraînent la dégradation et la perte de neurones et de leurs connexions, conduisant à une perte progressive de la mémoire et de certaines fonctions cognitives.
Afin de mieux comprendre comment les cellules immunitaires du cerveau contribuent à la maladie d’Alzheimer, le Dr Gan et ses collègues ont d’abord établi l’empreinte moléculaire de chaque cellule microgliale dans le cerveau de malades, porteurs d’une mutation du gène TREM2 — une mutation que l’on sait associée à une augmentation considérable du risque de développer la maladie. Cette mutation particulière du gène TREM2, notée R47H, multiplie presque par trois le risque de développer une maladie d’Alzheimer, selon une étude publiée en 2013.
TREM2 (triggering receptor expressed on myeloid cells 2) est un récepteur principalement exprimé par la microglie du cerveau ; entre autres fonctions, il signale de moduler l’inflammation et le métabolisme par l’intermédiaire d’une enzyme appelée AKT. Or, une expérience menée sur des modèles murins d’Alzheimer a montré que l’inhibition de cette enzyme permettait d’inverser l’inflammation de la microglie et donc, de protéger les neurones du cerveau.
Des neurones protégés contre la toxicité synaptique
L’équipe a établi son modèle de souris en combinant deux souches : l’une était porteuse de la mutation R47H et l’autre présentait des agrégats de protéine Tau — l’une des principales caractéristiques pathologiques d’un cerveau atteint d’Alzheimer. Les modèles murins porteurs de la mutation présentaient des déficits liés à la mémoire (tout comme les patients humains) ; plus précisément, la mutation R47H « induisait et exacerbait les déficits de mémoire spatiale médiés par Tau chez les souris femelles », écrivent les chercheurs. En outre, leur microglie exprimait des niveaux élevés de cytokines pro-inflammatoires et présentait une voie de signalisation AKT hyperactive.
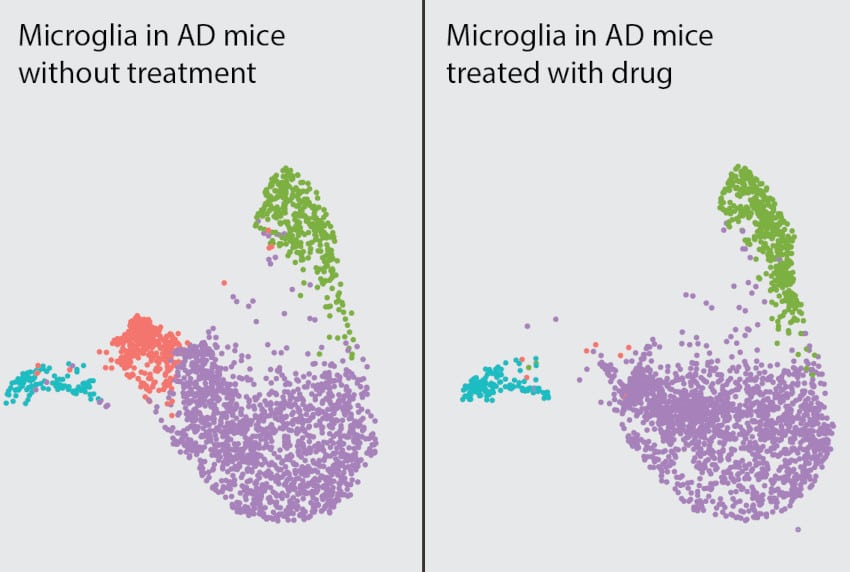


Les chercheurs ont donc tenté d’inhiber l’AKT chez les souris, à l’aide d’un médicament appelé MK-2206. Il se trouve que ce traitement est actuellement évalué dans le cadre de plusieurs essais cliniques sur le cancer. En effet, la signalisation AKT contribue aussi à la pathogenèse de nombreux types de cancer ; l’innocuité de ce traitement fait donc déjà l’objet d’une étude. L’équipe a pu constater que le MK-2206 a inversé les processus inflammatoires au niveau de la microglie et a même protégé les neurones contre la toxicité synaptique caractéristique de la maladie.
La mise en évidence des mécanismes de la mutation R47H qui favorisent la maladie d’Alzheimer confirme que les inhibiteurs de la signalisation AKT constituent une stratégie pertinente de modulation microgliale pour traiter la maladie. « Nos résultats soutiennent la poursuite de l’étude de [MK-2206] en tant que thérapie potentielle de la maladie d’Alzheimer », conclut le Dr Gan.