Des chercheurs de l’Université de Yale ont mis en évidence un mécanisme expliquant pourquoi des restrictions caloriques modérées — sans régime spécifique — modifient l’état immunométabolique du corps d’une manière à le faire rajeunir. Cette analyse est la plus solide jamais menée sur les effets des régimes hypocaloriques à long terme chez l’Homme. Une protéine pourrait en être la clé et constituer une nouvelle cible thérapeutique anti-âge.
Le vieillissement est un ensemble de processus entrainant le déclin structurel et fonctionnel de l’organisme, augmentant le risque de maladies et la mortalité. Les nombreux changements cellulaires et tissulaires liés à l’âge sont généralement considérés comme dégénératifs. Si l’on ne peut préciser lequel est celui qui déclenche tous les autres, nous savons que tous contribuent aux changements phénotypiques liés à l’âge et à la sensibilité face aux maladies.
À titre d’exemple, les maladies auto-immunes (surproduction d’anticorps s’attaquant aux constituants même de l’organisme) se développent, les phénomènes inflammatoires s’amplifient (réaction disproportionnée de l’organisme face à une infection) ou à l’inverse s’amoindrissent. Ces processus témoignent de la production restreinte de certains globules, les lymphocytes T.
Les personnes âgées sont dites immunodéprimées. Nous en avons fait la douloureuse expérience avec la pandémie de COVID-19. Elles furent les premières touchées, avec celles dont le système immunitaire était plus faible. Par la suite, l’immunité induite par les vaccins diminuait plus rapidement chez ce même type de personnes.
Réduire l’inflammation en réduisant l’apport calorique
Étudier les apports nutritionnels est pertinent dans la recherche anti-âge. Effectivement, il a été démontré que de nombreux êtres vivants, y compris les primates non humains, faisant face à des restrictions caloriques par manque de ressources (limitées ou indisponibles temporairement) dans certains milieux de vie, montrent un allongement de leur espérance de vie. Ils retardent leur vieillissement. En conséquence, les scientifiques de Yale ont testé si les régimes hypocaloriques à long terme généraient les mêmes avantages systémiques pour la santé chez l’homme. Spadaro et al. se sont focalisés sur la façon dont la restriction calorique (ou régime hypocalorique) à long terme chez l’homme influence la réponse immunitaire et l’inflammation.
« Nous savons que l’inflammation chronique chez l’homme est un déclencheur majeur de nombreuses maladies chroniques et, par conséquent, a un effet négatif sur la durée de vie », a déclaré dans un communiqué V. D. Dixit, co-auteur de l’étude et directeur du Yale Center for Research on Aging. Les gènes et voies intervenant dans la réponse à une restriction alimentaire contrôlent un large éventail de fonctions clés, comme la traduction des protéines, la fonction mitochondriale, le stress oxydatif, l’inflammation ainsi que le métabolisme cellulaire des graisses, des protéines et des glucides.
Pour leur étude, les chercheurs ont exploité les données issues d’un essai clinique historique débuté en 2007, appelé CALERIE. Plus de 200 sujets sains non obèses ont été étudiés, la moitié devait réduire son apport calorique de 25%. L’essai a duré deux ans, compilant un grand nombre de données physiologiques concernant les effets à long terme de la restriction calorique.
Sparado et ses collègues ont alors analysé le thymus, une glande se trouvant au-dessus du cœur, productrice des lymphocytes T (partie essentielle du système immunitaire). L’activité de cette glande est maximale chez l’enfant et le jeune adulte, mais elle vieillit plus rapidement que les autres organes. « Au moment où les adultes en bonne santé atteignent l’âge de 40 ans, 70% du thymus est déjà gras et non fonctionnel. Et en vieillissant, le thymus produit moins de lymphocytes T », précise Dixit. Les personnes âgées, comme dit plus haut, sont immunodéprimées.
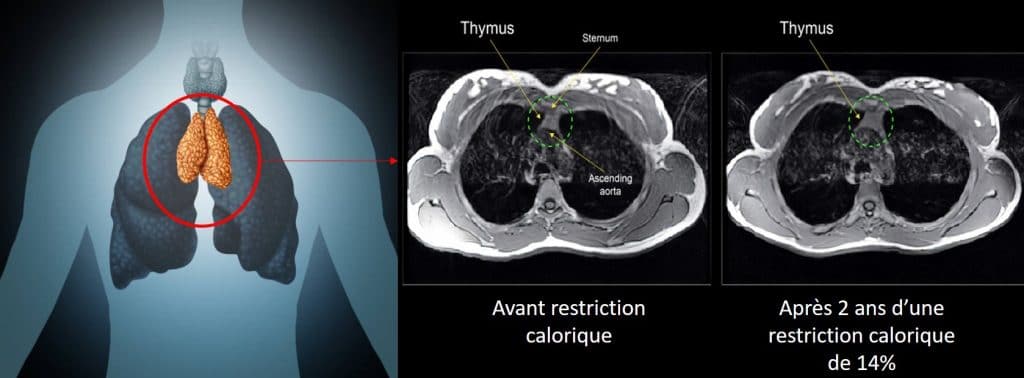
L’imagerie par résonance magnétique (IRM) a été utilisée pour déterminer s’il y avait des différences fonctionnelles entre les glandes thymus des deux groupes de l’essai. Le résultat est que l’organe semble avoir rajeuni ! En effet, les glandes présentaient moins de graisse et un plus grand volume fonctionnel après deux ans de restriction calorique : elles produisaient plus de lymphocytes T qu’au début de l’étude.
Malgré cette découverte spectaculaire, aucune différence dans l’expression des gènes de ces cellules immunitaires n’a pu être démontrée. « Il s’avère que l’action était vraiment dans le microenvironnement tissulaire et non dans les cellules T sanguines », a déclaré Dixit, en l’occurrence dans le tissu adipeux des participants à l’étude. Il faut savoir qu’il existe plusieurs types de cellules immunitaires dans les tissus adipeux. Lorsqu’elles sont suractivées, elles deviennent une source d’inflammation. L’équipe a mis en évidence des changements significatifs dans l’expression génétique du tissu adipeux. Un gène codant pour une protéine PLA2G7 a été fortement inhibé dans le groupe ayant suivi un régime hypocalorique.
Une protéine comme nouvelle source de jouvence ? Résultats à modérer…
Le gène PLA2G7 code pour une enzyme inflammatoire, la phospholipase A2, associée aux lipoprotéines Lp-PLA2. Elle se retrouve notamment au niveau des plaques d’athérosclérose. C’est un facteur d’activation plaquettaire (PAF). Ce dernier, formé après l’action de Lp-PLA2, provoque des agrégations plaquettaires, mais également des réactions inflammatoires aiguës, allant jusqu’au choc anaphylactique.
Une expérience de laboratoire chez la souris a démontré que l’inactivation du gène PLA2G7 diminue l’inflammation en améliorant les marqueurs de la fonction thymique et de certaines fonctions métaboliques chez les souris âgées. Cela serait dû au fait que PLA2G7 cible un mécanisme spécifique d’inflammation appelé l’inflammasome NLRP3, expliquent les chercheurs.
En plus de cela, une méta-analyse antérieure impliquant un total de 79 036 participants dans 32 études prospectives a révélé que les niveaux de Lp-PLA2 sont positivement corrélés à un risque accru de développer une maladie coronarienne et d’accident vasculaire cérébral. Un médicament pour inhiber la production de PLA2G7 a été développé, mais les essais cliniques (achevés en 2013) n’ont pas été concluants. PLA2G7 est aujourd’hui étudié pour jouer le rôle de marqueur de l’arthrosclérose, car se liant fortement aux plaques d’athérome, il permettra de localiser ces dernières par imagerie.
V.D. Dixit précise que « l’identification de ces facteurs nous aide à comprendre comment le système métabolique et le système immunitaire communiquent, ce qui peut nous indiquer des cibles potentielles susceptibles d’améliorer la fonction immunitaire, de réduire l’inflammation et, potentiellement, d’augmenter la durée de vie en bonne santé ».
Malgré ces bénéfices, le maintien de la restriction calorique et la prévention de la malnutrition sont difficiles chez l’homme, et liés à des effets secondaires importants. Par exemple, une réduction prolongée de l’apport calorique peut nuire à la cicatrisation des plaies, réduire le potentiel de lutte contre les infections, conduire à l’ostéoporose et diminuer la fertilité et la libido.
Situé à l’intersection du métabolisme et de l’immunité, PLA2G7 pourrait médier les effets immunométaboliques de la restriction calorique afin de réduire l’inflammation et prolonger l’espérance de vie, sans les effets négatifs d’une réelle restriction. Elle serait une cible de choix pour un nouveau traitement anti-âge, ou du moins pour « retarder l’apparition de maladies liées à l’âge », comme le déclare le Dr D. Belski, auteur principal de l’étude CALERIE.
Il peut y avoir un débat sur le meilleur type de régime à suivre, mais cette étude démontre que le simple fait de manger moins peut suffire à générer des avantages substantiels pour la santé.


