Les recherches sur le vieillissement tentent de comprendre ses mécanismes et les différents facteurs qui l’influencent, dans l’espoir de le ralentir, voire de le stopper dans une vision très utopique. Mais les modifications du corps liées à l’âge, outre les maladies, restent pour la plupart incomprises. Il est difficile de rassembler toutes les pièces de cet immense puzzle. Récemment, des chercheurs américains affirment avoir découvert la manière dont des mutations génétiques, accumulées au cours d’une vie, entrainent des changements au niveau de la production de sang, responsables de la soudaine fragilité des personnes après 70 ans. Cette nouvelle théorie sur le vieillissement révolutionne notre vision et les perspectives de nouveaux traitements quant aux pathologies liées à l’âge, ainsi que pour certains cancers du sang.
Il est admis, dans la communauté scientifique, que toutes les cellules du corps humain acquièrent, tout au long d’une vie, des modifications génétiques appelées mutations somatiques. À l’inverse des mutations germinales, ces mutations génétiques ne sont pas transmises à la descendance, disparaissant avec l’individu à sa mort. Prises individuellement, ces mutations sont dites viables, car elles ne tuent pas les cellules qui les portent.
Néanmoins, quand leur nombre devient important, les choses se compliquent. Ainsi, le vieillissement serait très probablement causé par l’accumulation de plusieurs dommages cellulaires au fil du temps. Toutes ces mutations somatiques feraient perdre aux cellules leur réserve fonctionnelle, dégradant peu à peu le fonctionnement du corps. En particulier, les modifications de l’hématopoïèse humaine — tous les processus assurant le remplacement continu et régulier des cellules sanguines —, liées à l’âge, entraînent une réduction de la capacité de régénération, des cytopénies, un dysfonctionnement immunitaire et un risque accru de cancer du sang. Mais le processus, provoquant une détérioration soudaine et brutale des organes après 70 ans, est encore loin d’être compris et connu.
C’est pourquoi des chercheurs du Wellcome Sanger Institut et du Cambridge Stem Cell Institut ont étudié la composition sanguine d’un panel d’individus allant des nouveau-nés aux personnes âgées. La découverte d’un changement radical, au niveau cellulaire, fournit une nouvelle théorie du vieillissement, publiée dans la revue Nature.
Un changement « catastrophique » dans la production sanguine
Pour mieux comprendre ce processus de vieillissement, l’équipe a étudié la production de cellules sanguines à partir de la moelle osseuse, en analysant 10 individus âgés de 0 (quelques mois) à 81 ans. Ils ont séquencé les génomes entiers de 3579 cellules souches sanguines, identifiant toutes les mutations somatiques contenues dans chaque cellule. L’équipe l’a utilisé pour construire les « arbres généalogiques » des cellules souches sanguines de chaque personne, montrant, pour la première fois, une vision impartiale des relations entre les cellules sanguines et la façon dont ces relations changent tout au long de la vie.
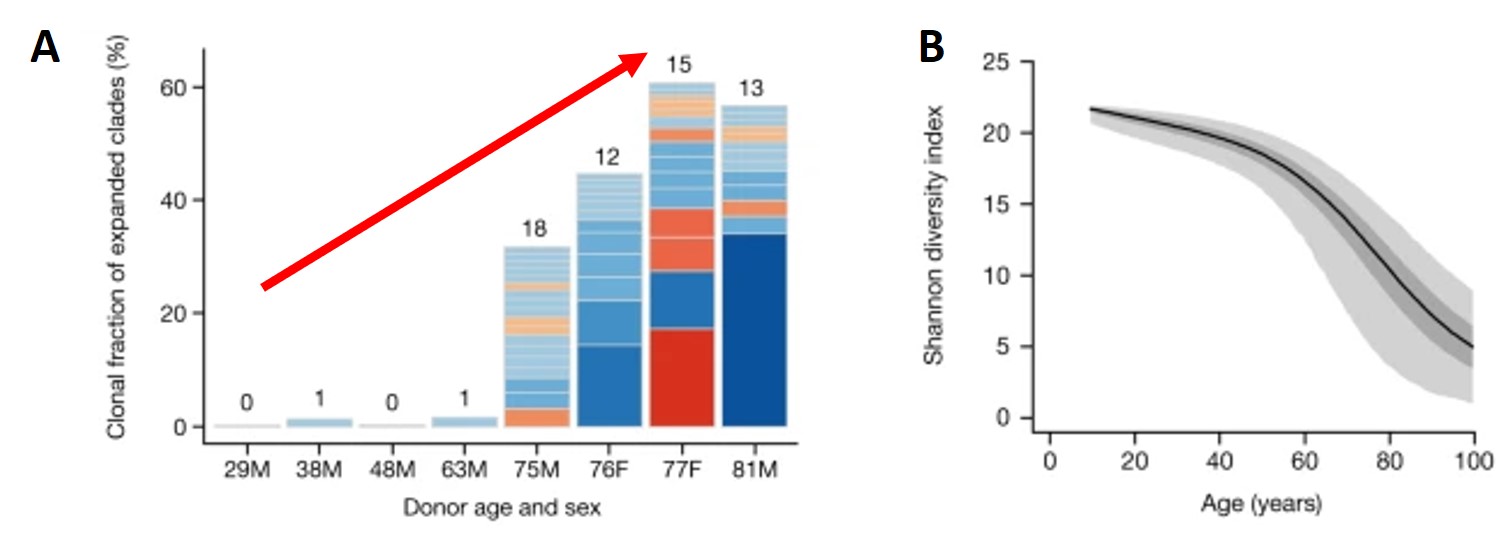
Dans un premier temps, les chercheurs ont découvert que les cellules souches hématopoïétiques (responsables de la production des cellules sanguines) ont accumulé en moyenne 17 mutations par an après la naissance.
Dans un second temps, ils ont constaté que l’hématopoïèse chez les adultes de moins de 65 ans était massivement polyclonale, c’est-à-dire provenant d’une grande diversité de types de cellules souches issues de la moelle osseuse. En effet, elle fait intervenir entre 20 000 et 200 000 types de cellules souches hématopoïétiques, contribuant uniformément à la production de sang. Ce qui n’est plus le cas après 70 ans. Certes, l’hématopoïèse est toujours polyclonale, mais ne fait intervenir que 10 à 20 types de cellules souches différentes. Sans compter que ce petit nombre contribue de manière totalement inégale à la production de cellules sanguines.
Une dominance génétique en fin de vie
Les auteurs estiment que ces 10 à 20 types de cellules souches se sont progressivement multipliées tout au long de la vie, du fait de mutations somatiques rares appelées « mutations motrices ». En effet, ces mutations accélèrent la croissance des cellules souches, produisant souvent des cellules sanguines de qualité inférieure. Puis elles finissent par remplacer les milliers de types de cellules souches présentes au départ.
La Dr Elisa Laurenti, du Wellcome-MRC Cambridge Stem Cell Institute, co-auteure de l’étude, déclare que l’inflammation chronique, le tabagisme, l’infection et la chimiothérapie pourraient provoquer une croissance plus précoce de ces cellules souches, potentiellement porteuses de mutations cancérigènes. Elle ajoute dans un communiqué : « Nous prévoyons que ces facteurs favorisent également le déclin de la diversité des cellules souches sanguines associé au vieillissement. Il est possible que certains facteurs ralentissent également ce processus ».
En conséquence, l’apparition régulière de « mutations motrices » provoquant la croissance de clones fonctionnellement altérés, explique le passage dramatique et inévitable à une diversité réduite des populations de cellules sanguines après l’âge de 70 ans. Le taux de mutations variant d’une personne à l’autre, cela explique l’inégalité face au risque de maladies chez les personnes âgées.
Sans compter que les auteurs soulignent que ce processus serait à l’oeuvre dans de nombreux autres tissus du corps. Ils concluent : « Nous avons maintenant la tâche passionnante de comprendre comment ces mutations nouvellement découvertes affectent la fonction sanguine chez les personnes âgées, afin que nous puissions apprendre à minimiser le risque de maladies et à promouvoir un vieillissement en bonne santé ».
Des mutations responsables du développement des cancers du sang
Ces découvertes ouvrent également la voie à de nouvelles recherches concernant les cancers du sang. Effectivement, plusieurs membres de l’équipe précédente, associés à d’autres collaborateurs, ont publié dans la revue Nature, le même jour, une étude portant sur la manière dont ces mutations génétiques motrices détournent la production de cellules sanguines à différentes périodes de la vie et leurs implications dans le développement de maladies associées.
Comme mentionné précédemment, toutes les cellules humaines acquièrent des modifications génétiques dans leur ADN tout au long de leur vie. Mais un sous-ensemble, les « mutations motrices », est pointé du doigt comme étant responsable de la soudaine fragilité après 70 ans, liée à la perte de diversité des cellules souches sanguines. Ce processus d’hématopoïèse clonale, devenant omniprésent avec l’âge, constitue un facteur de risque de cancers du sang et d’autres affections liées à l’âge.
Pour comprendre le lien entre l’hématopoïèse clonale et les maladies liées à l’âge, les chercheurs ont suivi près de 700 clones de cellules sanguines de 385 personnes âgées de plus de 55 ans, faisant partie de l’étude longitudinale SardiNIA — projet d’étude des habitants de Sardaigne pour identifier les bases génétiques des changements liés à l’âge. Les participants ont donné régulièrement des échantillons de sang pendant 16 ans.
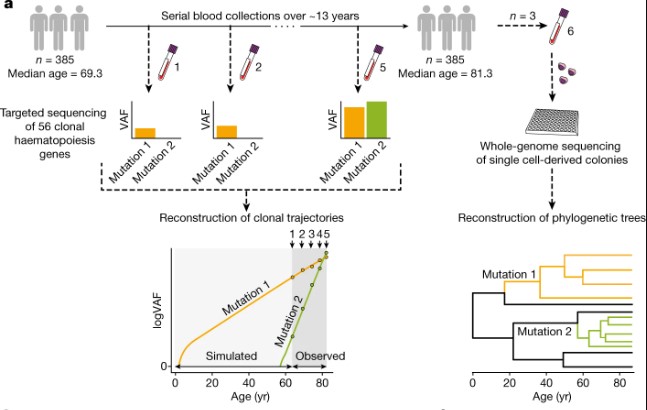


Ainsi, les auteurs ont constaté, lors du séquençage de l’ADN des échantillons de sang, que 92,4% des clones se sont développés avec un taux exponentiel au cours de la période étudiée. Par suite, l’équipe a utilisé des modèles mathématiques pour déduire le schéma de croissance de ces cellules souches porteuses de « mutations conductrices » et de leurs clones, au cours d’une vie.
Le Dr Moritz Gerstung, co-auteur principal de l’étude, explique dans un communiqué : « Pour la première fois, nous avons pu utiliser l’analyse génomique pour comprendre le passé, le présent et l’avenir des clones mutants dans notre sang. Ces données montrent que la dynamique des clones sanguins est étonnamment prévisible sur une période de plusieurs années, mais change au cours d’une vie, d’une manière que nous ne comprenons pas encore ».
D’ailleurs, les chercheurs ont découvert que le comportement des clones changeait considérablement avec l’âge en fonction de l’identité du gène muté. Ils ont mis en évidence deux gènes principaux : DNMT3A et TET2. D’un côté, les clones liés aux mutations dans DNMT3A se sont développés rapidement chez les jeunes, puis ont ralenti chez les personnes âgées. Tandis que les clones liés aux mutations dans TET2 se sont développés uniformément tout au long de la vie. Ils sont alors devenus plus courants que ceux liés à DNMT3A, après l’âge de 75 ans.
Le professeur Georges Vassiliou, co-auteur principal des deux études, conclut : « Collectivement, nos travaux révèlent une interaction étonnante entre l’avancée en âge et les mutations de l’ADN de nos cellules sanguines, qui se traduit par l’expansion de cellules présentant différentes mutations à différents âges. Ces changements conduisent à l’émergence de différents types de cancers du sang à différents âges et avec différents risques de progression ».
Par conséquent, ces deux études complémentaires ouvrent la voie à de nouvelles approches et de nouveaux traitements avec l’espoir de stopper le développement des cancers du sang, et permettre un vieillissement en meilleure santé.



