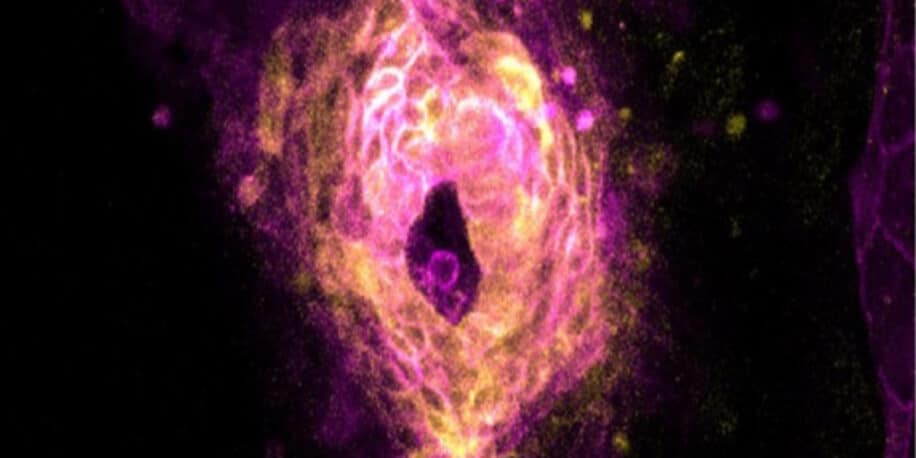
Grâce à une technique d’imagerie microscopique à grande vitesse, des chercheurs ont capturé le moment exact où les cellules cardiaques d’embryons de poissons-zèbres ont commencé à battre. Elles se mettent soudainement à se contracter à l’unisson et se synchronisent rapidement. Cette avancée pourrait nous permettre de mieux comprendre comment l’arythmie ou d’autres défaillances cardiaques se développent chez l’Homme.
Le développement d’un organisme à part entière à partir d’un amas de quelques cellules est un processus extrêmement complexe, nécessitant une organisation et une synchronisation ultraprécises. Chez les vertébrés, le cœur est l’un des premiers organes à fonctionner au cours du développement embryonnaire. Cependant, le mécanisme de transition depuis un amas de cellules statiques vers un réseau contractile est largement méconnu. En effet, si l’activité cardiaque au début de l’embryogenèse est documentée depuis plus de 2000 ans, les observations de la dynamique physiologique régissant cette étape sont relativement limitées. Cela implique que les mécanismes bioloéléctriques des premiers instants de la fonction cardiaque, étaient jusqu’à présent insaisissables.
Dans cette optique de recherche, une équipe de l’École de médecine de Harvard (HMS) s’est demandée : comment le cœur embryonnaire enclenche-t-il sa première contraction ? Comment les cardiomyocytes se coordonnent-ils afin de régulariser le rythme des battements au sein du tissu cardiaque ? Leur technique d’imagerie a permis de sonder ces questions en profondeur. « Les gens accordent une telle importance aux battements du cœur qu’ils sont au centre des recherches depuis longtemps, mais c’est la première fois que nous pouvons l’examiner en profondeur avec autant de résolution », explique le coauteur principal de l’étude, Sean Megason, professeur de biologie des systèmes à la HMS.
La compréhension de ces mécanismes fondamentaux permettrait de connaître ceux régissant les défaillances cardiaques se développant in utero. « Le cœur bat environ 3 milliards de fois au cours d’une vie humaine typique, et il ne doit jamais faire de pause », indique Adam Cohen, également auteur de l’étude et professeur de chimie, de biologie chimique et de physique à Harvard. « Nous voulions voir comment cette incroyable machine se mettait en marche pour la première fois », ajoute-t-il.
« C’était comme si quelqu’un avait appuyé sur un interrupteur »
Avant d’effectuer leurs expériences d’imagerie, les chercheurs ont avancé plusieurs hypothèses concernant les premiers instants du myocarde embryonnaire. L’une d’elles suggérait que quelques cellules commenceraient d’abord à battre, puis les contractions se propageraient lentement à travers le tissu. Une autre avançait la possibilité qu’il y ait différentes zones distantes se contractant indépendamment pour finalement fusionner. Il a aussi été suggéré que l’ensemble du tissu commence par se contracter faiblement pour gagner en puissance au fil du temps. Pour vérifier cela, l’imagerie calcique à grande vitesse a été utilisée sur des embryons de poissons-zèbres (Danio rerio), 18 à 22 heures après la fécondation. Ce poisson constitue un modèle d’étude de prédilection en cardiologie, car il est translucide et grandit rapidement, sans compter la possibilité d’en imager plusieurs à la fois.
Leur développement a été surveillé au sein d’un moule de gel d’agarose et serait transposable à la plupart des vertébrés. Au cours de cette période, les populations de cellules progénitrices cardiaques bilatérales se rassemblent pour former une structure en forme de cône. Étant donné la différenciation rapide et massive de ces cellules, un capteur d’ions calcium (une protéine fluorescente) a été incorporé afin de capturer toute activité potentielle. En intégrant un système d’électrophysiologie optique à grande échelle, le protocole permettait d’imager directement et simultanément jusqu’à 18 embryons.
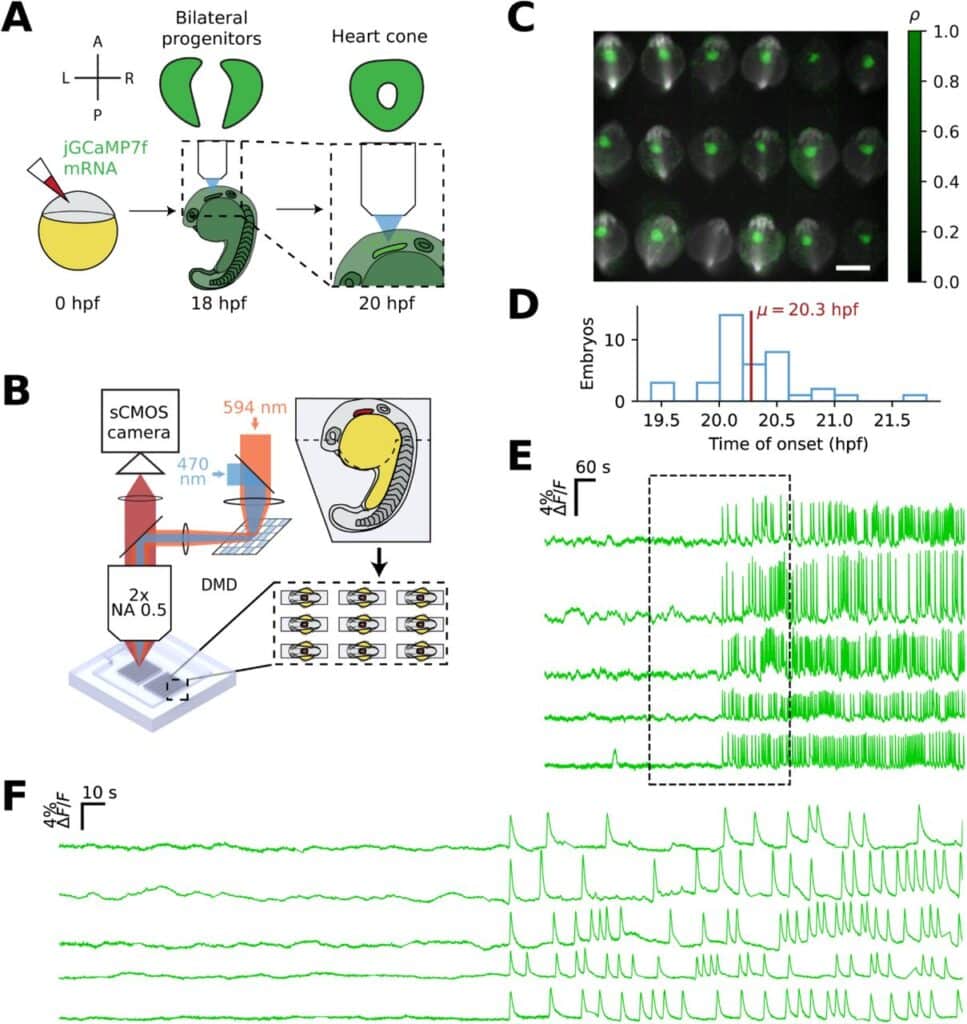
Les chercheurs ont constaté qu’aucune des hypothèses précédemment mentionnées n’était entièrement correcte. À leur grande surprise, ils ont découvert qu’un ensemble de cardiomyocytes passait soudainement d’un état statique à la contractilité. Ils commençaient à battre à l’unisson pour se synchroniser spontanément. Le phénomène se manifeste par des pics simultanés de signaux calciques et électriques. « C’était comme si quelqu’un avait appuyé sur un interrupteur », déclare Cohen. La transition s’effectuait dans une fenêtre étroite de développement, durant environ 20 heures. De plus, la dynamique rythmique du calcium apparaissait bien avant que les contractions mécaniques puissent être détectées. On peut ainsi considérer que la transition calcique à grande échelle constitue le tout premier battement cardiaque.
Dans un deuxième temps, les chercheurs ont tenté de déterminer si le premier battement engageait l’ensemble du tissu ou s’il se limitait à un sous-ensemble de cellules. Des expériences précédentes ont révélé que pour chaque battement cardiaque, une région du cœur se contracte en premier et propage une vague de potentiel d’action traversant rapidement le reste des cellules. Les experts de Harvard ont révélé que le premier battement initie un changement majeur, appuyant de ce fait ces résultats. Des activités transitoires unicellulaires lentes et clairsemées deviennent notamment des pics aigus à l’échelle du tissu. Ces activités ont gagné en stabilité et en synchronisation dès l’heure suivant la première contraction.
Ces résultats suggèrent que les cardiomyocytes peuvent battre individuellement afin de donner lieu au premier battement unifié. Pour l’analogie, les cardiomyocytes seraient comparables à une armée qui doit commencer à marcher de manière synchronisée et sans entraînement préalable. À partir de ce qui semble être un désordre total, ils s’organisent très rapidement et « un battement rythmique et spatialement structuré apparaît bien avant la connexion au système circulatoire et au pompage du sang », précisent les chercheurs dans leur rapport, publié dans la revue Nature.
Il est intéressant de noter que la région de contraction primordiale différait chez chaque poisson. Il s’agit d’une découverte contre-intuitive étant donné que les cellules du cœur adulte se comportent de manière complètement différente. En effet, le cœur mature possède une population spécialisée de cellules stimulatrices, régulant le rythme cardiaque. Comme les cardiomyocytes embryonnaires ont la capacité de battre d’eux-mêmes, « cela rend difficile la prédiction de l’emplacement des premiers battements », explique le chercheur principal de l’étude, Bill Jia, également du HMS. Ces découvertes pourraient constituer une grande avancée dans la compréhension du développement de l’arythmie et d’autres affections cardiaques, ce qui pourrait sur le long terme aboutir à la conception de nouveaux traitements.