Une nouvelle étude suggère que le champignon Candida albicans est impliqué dans certaines pathologies neurodégénératives, telles qu’Alzheimer. Elle éclaire notamment les mécanismes biomoléculaires sous-jacents : la levure en question active deux processus distincts liés à sa capacité à envahir le cerveau et à sa clairance naturelle. La perturbation de ces mécanismes prolonge la mycose cérébrale et entraîne une accumulation de protéines β-amyloïdes — habituellement associées à la pathogénicité d’Alzheimer.
C. albicans, ainsi que d’autres genres Candida, fait naturellement partie du microbiote commensal de nos muqueuses. Cependant, en devenant opportuniste (en cas de déficit immunitaire par exemple), il peut parfois provoquer de graves infections. La mycose cérébrale due à cette espèce constitue la forme la plus fréquente de cérébrite. D’autre part, la levure a été retrouvée au niveau du cerveau de personnes souffrant d’Alzheimer et d’autres pathologies neurodégénératives chroniques. De manière étonnante, ces patients ne présentent ni des symptômes d’infection aiguë tels que la fièvre ni d’altération rapide de l’état mental. Cela signifie que l’infection cérébrale de genre microbien ne déclenche pas d’immunité « stérilisante » et peut persister sur le long terme dans certains cas.
Depuis peu, certaines études suggèrent une origine microbienne d’Alzheimer. En 2019, des chercheurs ont démontré qu’en pénétrant dans le cerveau, le genre Candida provoque des changements similaires à ceux observés dans la maladie.
La nouvelle étude, publiée dans la revue Cell Reports et codirigée par la même équipe d’experts que celle de 2019, visait à explorer plus avant les mécanismes biomoléculaires derrière ce lien, en se concentrant notamment sur C. albicans — responsable de la moitié des candidoses. En effet, malgré les preuves croissantes de l’implication du champignon dans la pathologie, la manière exacte dont il y contribue n’est pas entièrement explorée. « Ce travail pourrait apporter une nouvelle pièce importante du puzzle concernant le développement de la maladie d’Alzheimer », estime l’auteur correspondant David Corry, du Baylor College of Medicine.
Deux processus liés à l’accumulation de peptides β-amyloïdes
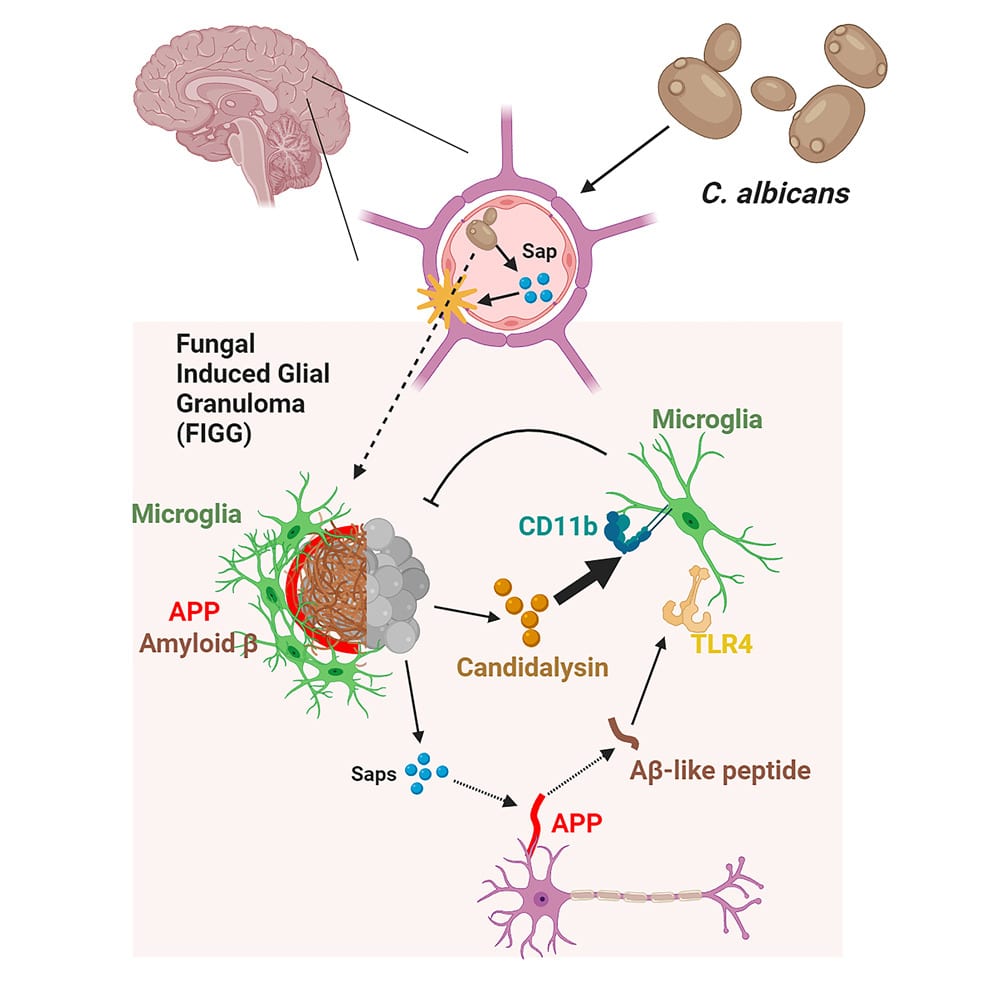
En pénétrant dans notre organisme ou en devenant opportunistes, les champignons déclenchent généralement une réaction immunitaire phagocytaire, peptidique, oxydative et inflammatoire. C. albicans est spécifiquement détecté par le système immunitaire par le biais de la candidalysine, une toxine peptidique qu’il sécrète. De façon surprenante, lors d’une mycose cérébrale aiguë de bas grade par cette levure, les macrophages, les neutrophiles et les lymphocytes censés être activés ne sont pas détectés au niveau du cerveau chez les modèles murins. En revanche, il se produit une forte activation microgliale induisant sa destruction. Les chercheurs du Baylor College of Medecine ont précédemment démontré que chez les souris ne présentant pas de maladie sous-jacente, l’infection au champignon est entièrement éliminée au bout de 10 jours.
Cependant, le processus conduisant à la clairance (le rapport entre la quantité d’une substance éliminée par unité de temps et la concentration dans un fluide de l’organisme de cette même substance) du champignon demeure jusqu’à présent méconnu, de même que la manière dont il parvient à franchir la barrière hématoencéphalique. La capacité de C. albicans à pénétrer rapidement dans le cerveau par voie systémique suggère qu’il se sert d’un mécanisme particulier lui permettant de perturber la structure de cette barrière. Étant donné que l’intégrité de cette dernière est en partie basée sur des jonctions protéiniques serrées, les chercheurs de l’étude ont supposé que la levure déclenche une protéolyse afin de la traverser. En effet, elle sécrète 10 protéinases aspartiques (Saps), suffisamment puissantes pour dégrader la plupart des protéines humaines.
Les chercheurs ont confirmé cette hypothèse, en travaillant à nouveau sur des modèles murins. En outre, ils ont remarqué qu’en parvenant au niveau du parenchyme cérébral, les Saps dégradent également la protéine précurseur de l’amyloïde (APP), exprimée par voie neuronale sous la forme de peptides β-amyloïdes et se liant au récepteur Toll-like 4 (TLR4) d’activation microgliale. Ce mécanisme vise à détruire les champignons dans le cerveau (clairance), de sorte à maintenir une faible charge fongique, sans toutefois les éliminer complètement.
D’un autre côté, la candidalysine produite par le champignon contribue également à sa clairance en se liant aux microglies par le biais du récepteur intégrine CD11b. La perturbation de cette voie entraîne une infection prolongée. « L’activation des microglies médiée par la candidalysine est essentielle à l’élimination de C. albicans dans le cerveau. Si nous supprimons cette voie, les champignons ne sont plus efficacement éliminés du cerveau », explique l’auteur principal de l’éude, Yifan Wu, du Baylor College of Medicine.
Dans l’ensemble, l’altération de ces processus de clairance entraîne une accumulation toxique de peptides β-amyloïdes, pouvant conduire à la neurodégénérescence. Il est important de savoir qu’il est généralement considéré que nos propres protéases cérébrales peuvent conduire à l’accumulation endogène de ces peptides. La présente étude démontre que ces derniers peuvent être générés à partir d’une source différente. « Nous proposons que les agrégats cérébraux de peptides β-amyloïdes qui caractérisent plusieurs maladies neurodégénératives (Alzheimer, Parkinson, …) associées à Candida, peuvent être générés à la fois intrinsèquement par le cerveau et par le champignon », suggère Corry. Ces résultats pourraient potentiellement conduire au développement de meilleures stratégies thérapeutiques.