La maladie d’Alzheimer est une maladie neurodégénérative qui n’apparaît que tardivement dans la vie chez les sujets prédisposés. Les symptômes de la maladie sont notamment dus à l’accumulation des protéines Tau et β-amyloïde dans le cerveau. Mais pourquoi certaines personnes sont-elles prédisposées à cette accumulation ? Des chercheurs de l’Université métropolitaine de Tokyo ont découvert un nouveau mécanisme en cause. Des résultats qui pourraient conduire à des traitements révolutionnaires.
Les chercheurs ont découvert un nouveau mécanisme par lequel les amas de protéines tau sont créés dans le cerveau, tuant les cellules cérébrales et provoquant la maladie d’Alzheimer. Comme le montre leur étude, une mutation spécifique d’une enzyme appelée MARK4 modifie les propriétés de tau, représentant une partie importante de la structure squelettique des cellules, la rendant plus susceptible de s’agréger et plus insoluble. Comprendre davantage de tels mécanismes pourrait conduire à des traitements révolutionnaires. Les résultats ont été publiés dans la revue Journal of Biological Chemistry.
La maladie d’Alzheimer est une maladie débilitante qui change peu à peu et drastiquement la vie. Elle touche des dizaines de millions de personnes dans le monde. Selon l’Organisation mondiale de la santé, il s’agit de la cause la plus fréquente de démence sénile, avec des chiffres dans le monde qui devraient doubler tous les 20 ans si rien n’est entrepris.
Selon nos connaissances actuelles, la maladie d’Alzheimer est principalement causée par l’accumulation d’amas enchevêtrés de protéines tau dans les cellules cérébrales. Ces agrégats collants provoquent la mort des neurones, entraînant une altération de la mémoire et des fonctions motrices. Jusqu’ici, on ne savait pas comment ni pourquoi la tau s’accumule dans les cellules cérébrales des patients atteints de la maladie d’Alzheimer. Comprendre la cause et le mécanisme de cette agglutination indésirable ouvrira la voie à de nouveaux traitements et à des moyens de prévenir la maladie.
Une mutation génétique en cause
Une équipe dirigée par le professeur Kanae Ando de l’université métropolitaine de Tokyo explore le rôle joué par l’enzyme MARK4 (Microtubule Affinity Regulating Kinase 4) dans la maladie d’Alzheimer. Lorsque tout fonctionne normalement, la protéine tau constitue une partie importante de la structure des cellules, ou du cytosquelette. Pour que les bras du cytosquelette ou des microtubules se construisent et se désassemblent constamment, MARK4 aide la protéine tau à se détacher des bras de cette structure.
Les problèmes commencent lorsqu’une mutation se produit dans le gène qui fournit le modèle pour la fabrication de la MARK4. Des travaux antérieurs avaient déjà associé cela à un risque accru de maladie d’Alzheimer, mais on ne savait pas pourquoi. Pour en savoir plus, l’équipe a introduit artificiellement des mutations dans des drosophiles transgéniques qui produisent également la protéine tau humaine, et a étudié comment les protéines se comportaient in vivo. Les chercheurs ont alors découvert que cette forme mutante de MARK4 apporte des modifications à la protéine tau, créant une forme pathologique de cette dernière.
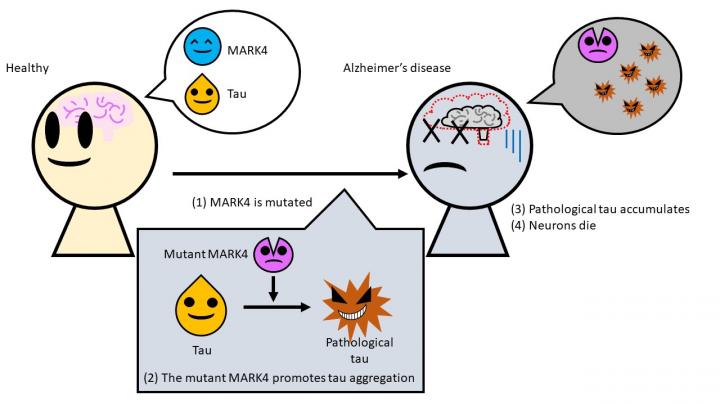
Non seulement cette « mauvaise » tau montrait un excès de certains groupes chimiques qui la faisait se replier, mais ils ont découvert qu’elle s’agrégeait beaucoup plus facilement et n’était plus soluble dans les détergents. La protéine tau a donc pu former plus facilement les amas enchevêtrés qui provoquent la dégénérescence des neurones.
L’enzyme MARK4 altérée s’est également avérée provoquer une large gamme d’autres maladies qui impliquent l’agrégation et l’accumulation d’autres protéines. C’est pourquoi les connaissances de l’équipe sur l’accumulation de protéines tau pourront, on l’espère, conduire à de nouveaux traitements et à des mesures préventives pour une variété encore plus large de maladies neurodégénératives.


