Des chercheurs ont développé des cellules musculaires bovines capables de produire leur propre facteur de croissance et de se multiplier quasi indéfiniment. Les facteurs de croissance accaparant près de 90 % du coût total de production de la viande de synthèse, cela devrait considérablement réduire son prix. La stratégie pourrait également s’appliquer à d’autres types de viandes, comme le porc ou le poulet.
Les technologies de culture de viande artificielle ont principalement pour objectif de réduire les impacts environnementaux de l’industrie de la viande — notamment en utilisant moins de ressources (comme l’eau) — tout en étant plus éthiques. La production de viande d’élevage (surtout la viande bovine) est en effet largement pointée du doigt pour son importante empreinte carbone (par rapport à d’autres produits agroindustriels).
Cependant, bien que la viande de culture soit désormais disponible à la vente dans certains pays comme les États-Unis et les Pays-Bas, il reste de nombreux obstacles avant que ses avantages puissent avoir un impact à grande échelle. Une récente analyse a d’ailleurs rapporté que pour le moment, en vue de son coût de production, la viande de culture serait bien plus néfaste pour l’environnement que la viande conventionnelle.
En effet, la production de viande de synthèse est extrêmement coûteuse et énergivore. Les coûts dépendent surtout des milieux de culture, contenant généralement des composants très onéreux tels que le sérum fœtal bovin et les complexes de protéines recombinantes. Les facteurs de croissance — produits à partir de protéines recombinantes — accapareraient près de 90 % du coût total de production. Ces composés sont notamment périssables en seulement quelques jours et doivent régulièrement être reconstitués dans les milieux de culture. Cela limite considérablement la rentabilité des produits finaux.
Des chercheurs de l’Université de Tufts dans le Massachusetts (aux États-Unis) ont suggéré que l’autoproduction de ces facteurs de croissance par les cellules animales pourrait significativement réduire les coûts. Dans leur nouvelle étude décrite dans la revue Cell Reports Sustainability, ils proposent entre autres une technique permettant de stimuler la croissance des cellules bovines sans ajout exogène de facteurs spécifiques dans le milieu de culture.
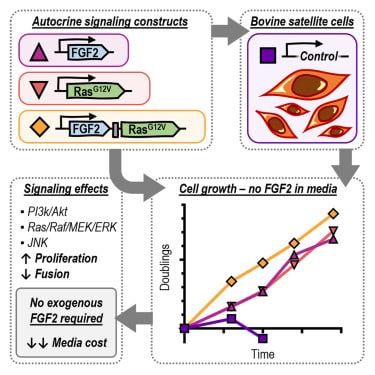
Des cellules qui se différencient presque indéfiniment
Le principal facteur de croissance utilisé pour les milieux de culture de viande artificielle est le facteur de croissance des fibroblastes recombinés 2 (FGF2). Il s’agit de l’un des 22 FGF impliqués dans le développement et la régénération des cellules et des tissus. Il agit en se liant aux récepteurs FGF présents à la surface des cellules souches musculaires (ou cellules satellites) et active les voies de différenciation. Au niveau des muscles, l’activation de ces voies maintient la différenciation tout en inhibant la fusion cellulaire.
Récemment, un milieu de culture sans sérum pour cellules satellites bovines (BSC) a été développé dans le but de réduire les coûts. En effet, les sommes investies étaient initialement déterminées par l’albumine recombinante et le FGF2. Si la première a pu être remplacée par des protéines de colza (à faible coût), il n’y avait jusqu’à présent pas d’alternative pour le second. « Par conséquent, réduire le coût du FGF2 est une priorité évidente pour parvenir à des milieux de culture plus abordables », ont estimé les chercheurs de l’Université de Tufts.
Dans cette vision, ils ont modifié génétiquement les BSC de sorte qu’elles produisent leurs propres FGF2 et s’autodifférencient en cellules musculaires squelettiques (composant la viande de bœuf que nous consommons). « Ce que nous avons fait, c’est concevoir des cellules souches musculaires bovines pour produire ces facteurs de croissance et qu’elles activent elles-mêmes les voies de signalisation », explique dans un article blog de l’Université, Andrew Stout, directeur scientifique du centre Tufts Cellular Agriculture Commercialization Lab et chercheur principal du projet.
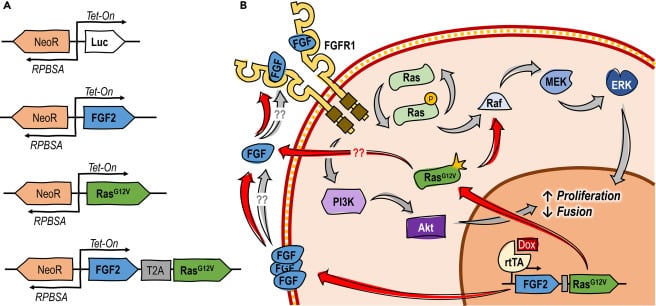
Pour ce faire, ils ont inséré dans les cellules souches des plasmides contenant de petites molécules d’ADN permettant de modifier leur activité interne et de produire du FGF2. Cela permettrait aux cellules de se différencier presque indéfiniment, par rapport à l’ajout exogène de facteurs de croissance. D’autre part, la technique n’introduit pas de gènes étrangers, car elle modifie uniquement l’activité des gènes déjà présents à l’intérieur des cellules. Étant donné que l’utilisation de gènes non natifs à l’espèce étudiée est soumise à des réglementations plus strictes, cette approche possède ainsi un avantage significatif quant aux procédures d’approbation.
En outre, étant donné que la différenciation de toutes les cellules musculaires s’effectue par le biais du FGF2, les chercheurs estiment que leur technique pourrait également s’appliquer à d’autres viandes, comme le porc et le poulet — bien qu’il puisse y avoir une variabilité dans l’expression des meilleurs facteurs de croissance, selon les espèces.
Toutefois, « même si nous avons considérablement réduit le coût des médias, il reste encore quelques optimisations à faire pour les rendre prêts pour l’industrie », précise Stout. En effet, la vitesse de croissance observée était tout de même inférieure à celle obtenue par l’ajout exogène de FGF2. De plus, l’utilisation de plasmides dans les produits alimentaires n’est légalisée que dans certains pays. Il n’a pas non plus été précisé si la technique permet véritablement de réduire les coûts énergétiques et environnementaux de la culture de viande in vitro.
Néanmoins, les chercheurs espèrent que la technique pourra au moins permettre d’étendre l’échelle de production de viande artificielle, de sorte à en améliorer l’accessibilité pour les consommateurs. Selon les experts, leurs prochains travaux consisteront à explorer les techniques permettant de réduire le coût des nutriments pour les milieux de culture et d’améliorer l’apport nutritionnel des produits finaux.


