Le processus du vieillissement à l’échelle cellulaire fait intervenir des dizaines de mécanismes complexes différents. Bien que certains aient été identifiés au cours des dernières décennies, d’autres échappent encore aux biologistes. Mais récemment, une équipe de chercheurs américains a mis en lumière l’un des mécanismes cellulaires inflammatoires contribuant significativement au vieillissement et à ses conséquences, notamment l’apparition de maladies et le déclin cognitif. Les coupables ? Des cellules immunitaires dont le comportement finit par devenir erratique. Cette découverte pourrait déboucher sur un moyen de ralentir le vieillissement et prévenir l’apparition de pathologies associées.
Les biologistes ont longtemps émis l’hypothèse que la réduction de l’inflammation due à l’âge pourrait ralentir le processus de vieillissement et retarder l’apparition de maladies associées, telles que les maladies cardiaques, la maladie d’Alzheimer, le cancer, et peut-être même prévenir la perte progressive d’acuité mentale.
Pourtant, la question de savoir ce qui, exactement, amène certaines cellules du système immunitaire à déclencher une surmultiplication inflammatoire s’est longtemps trouvée sans réponse précise. Cependant, des chercheurs de Stanford pourraient en avoir trouvé une. Si leurs découvertes chez les souris âgées et dans les cultures de cellules humaines s’appliquent aux humains, elle pourraient présager la possibilité d’une récupération des capacités mentales chez les personnes âgées.
L’évolution erratique des cellules myéloïdes
Dans une étude publiée dans la revue Nature, les chercheurs attribuent la responsabilité de cette inflammation à un ensemble de cellules immunitaires appelées cellules myéloïdes. Les cellules myéloïdes, qui se trouvent dans le cerveau, le système circulatoire et les tissus périphériques du corps, sont à la fois soldats et agents d’entretien.
Lorsqu’elles ne combattent pas les intrus infectieux, elles sont occupées à nettoyer les débris, tels que les cellules mortes et les amas de protéines agrégées ; fournir des nutriments à d’autres cellules ; et servir de sentinelles à la recherche de signes d’envahissement d’agents pathogènes. Mais à mesure que nous vieillissons, les cellules myéloïdes commencent à négliger leurs fonctions normales de protection et à se retourner sans raisons concrète contre les tissus alentours.
Dans l’étude, le blocage de l’interaction d’une hormone particulière et d’un récepteur des cellules myéloïdes était suffisant pour restaurer le métabolisme juvénile et le tempérament normal des cellules myéloïdes de souris et humaines cultivées, et chez des souris vivantes. Ce blocage a également inversé le déclin mental lié à l’âge chez les souris plus âgées, rétablissant leurs capacités de mémoire et de déplacement au niveau de celles des jeunes souris.
« Si vous ajustez le système immunitaire, vous pouvez réduire le vieillissement du cerveau », indique Andreasson, Katrin Andreasson, professeur de neurologie. Les expériences de son équipe sur des cellules humaines suggèrent qu’un rajeunissement similaire peut être possible chez les humains.
La liaison PGE2-EP2 : elle est responsable de l’inflammation
Les cellules myéloïdes sont la principale source de PGE2, une hormone appartenant à la famille des prostaglandines. La PGE2 fait beaucoup de choses différentes dans le corps et peut, par exemple, favoriser l’inflammation. Ce que fait la PGE2 dépend des cellules et des différentes variétés de récepteurs présentes à la surface de ces cellules, sur lesquelles l’hormone agit. Un type de récepteur pour la PGE2 est EP2.
Ce récepteur se trouve sur les cellules immunitaires et est particulièrement abondant sur les cellules myéloïdes. Il initie une activité inflammatoire à l’intérieur des cellules après la liaison à la PGE2. L’équipe d’Andreasson a cultivé des macrophages, une classe de cellules myéloïdes situées dans les tissus de tout le corps, provenant de personnes âgées de plus de 65 ans, et les a comparées aux macrophages de personnes de moins de 35 ans. Ils ont également examiné les macrophages de souris jeunes par rapport à des souris âgées.
Ils ont observé que les macrophages plus âgés de souris et d’humains produisaient non seulement beaucoup plus de PGE2 que les plus jeunes, mais avaient également un nombre beaucoup plus grand de récepteurs EP2 à leur surface. Andreasson et ses collègues ont également confirmé des augmentations significatives des niveaux de PGE2 dans le sang et le cerveau des vieilles souris.
La réorientation de la chaîne d’utilisation du glucose
L’augmentation exponentielle résultante de la liaison PGE2-EP2 amplifie les processus intracellulaires associés à l’inflammation des cellules myéloïdes. Les chercheurs ont montré, dans les cellules myéloïdes humaines et murines, comment cette réaction inflammatoire s’installe. La liaison PGE2-EP2 considérablement accrue dans les cellules myéloïdes des personnes âgées modifie la production d’énergie au sein de ces cellules en réorientant le glucose — qui alimente la production d’énergie dans la cellule — de la consommation au stockage.
Les auteurs ont découvert que les cellules myéloïdes subissent une propension croissante (entraînée par une augmentation de la liaison PGE2-EP2 associée à l’âge) à accumuler du glucose en convertissant cette source d’énergie en longues chaînes de glucose appelées glycogène, au lieu de la « dépenser » pour la production d’énergie. Cette thésaurisation, et l’état chroniquement épuisé des cellules par la suite, les conduisent à une inflammation, faisant des ravages sur les tissus vieillissants.
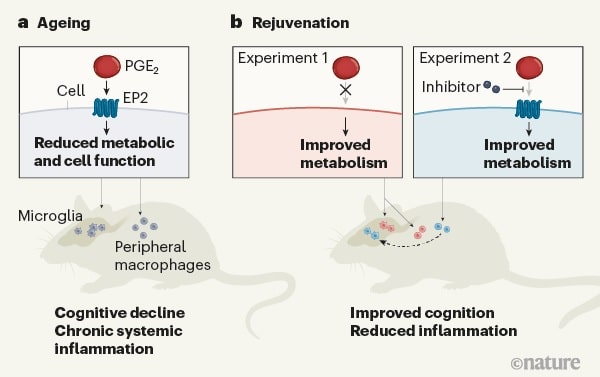


Cette réaction peut être inversée en bloquant la réaction des récepteurs hormonaux sur les surfaces des cellules myéloïdes chez les souris. Les chercheurs ont donné à des souris l’un ou l’autre des deux composés expérimentaux connus pour interférer avec la liaison PGE2-EP2 chez les animaux. Ils ont également incubé des macrophages de souris et humains en culture avec ces substances. Cela a amené les vieilles cellules myéloïdes à métaboliser le glucose tout comme les jeunes cellules myéloïdes, inversant le caractère inflammatoire des vieilles cellules.
Plus frappant, les composés ont inversé le déclin cognitif lié à l’âge des souris. L’un des deux composés utilisés par les scientifiques de Stanford a été efficace même s’il ne pénètre pas dans la barrière hémato-encéphalique. Cela suggère, déclare Andreasson, que même la réinitialisation des cellules myéloïdes à l’extérieur du cerveau peut avoir des effets profonds sur ce qui se passe à l’intérieur.


