Les cellules sanguines — globules rouges, globules blancs et plaquettes — sont toutes initialement issues des cellules souches hématopoïétiques (CSH). Au cours de l’hématopoïèse, ces cellules souches multipotentes se différencient ensuite en plusieurs progéniteurs qui donneront les cellules sanguines finales. Dans plusieurs pathologies du sang, des troubles affectant la moelle osseuse peuvent considérablement réduire la production de CSH. Mais récemment, des chercheurs ont découvert un mécanisme protéique permettant aux CSH de s’auto-renouveler, ouvrant ainsi la voie à de nouvelles solutions thérapeutiques.
Les scientifiques de l’UCLA ont découvert un lien entre une protéine et la capacité des cellules souches du sang humain à s’auto-renouveler. Dans une étude publiée dans la revue Nature, l’équipe rapporte que l’activation de la protéine provoque le renouvellement automatique des cellules souches du sang au moins douze fois dans des conditions de laboratoire.
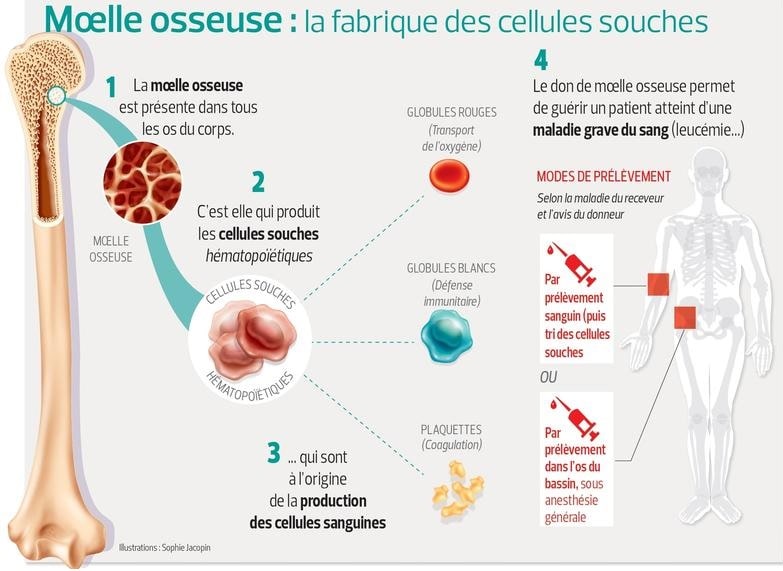
La multiplication des cellules souches sanguines dans des conditions extérieures au corps humain pourrait considérablement améliorer les options de traitement pour les cancers du sang tels que la leucémie et pour de nombreuses maladies du sang héréditaires. Les cellules souches sanguines, également appelées cellules souches hématopoïétiques, se trouvent dans la moelle osseuse, où elles se renouvellent et se différencient pour créer tous les types de cellules sanguines.
Pallier les problèmes de rejet dans le cas des greffes de moelle osseuse
Les greffes de moelle osseuse sont utilisées depuis des décennies pour traiter les personnes souffrant de certaines maladies du sang ou du système immunitaire. Cependant, elles ont des limites significatives : il n’est pas toujours possible de trouver un donneur compatible avec la moelle osseuse, le système immunitaire du patient peut rejeter les cellules étrangères et le nombre de cellules souches transplantées peut ne pas être suffisant pour traiter efficacement la maladie.
Lorsque les cellules souches du sang sont retirées de la moelle osseuse et placées dans des boites de laboratoire, elles perdent rapidement leur capacité à s’auto-renouveler et elles meurent ou se différencient en d’autres types de cellules sanguines. L’objectif de Mikkola, qui consiste à autoriser le renouvellement automatique des cellules souches sanguines dans des conditions de laboratoire contrôlées, ouvrirait de nombreuses possibilités nouvelles pour le traitement de nombreuses maladies du sang, parmi lesquelles le génie génétique plus sûr des cellules souches sanguines des patients.
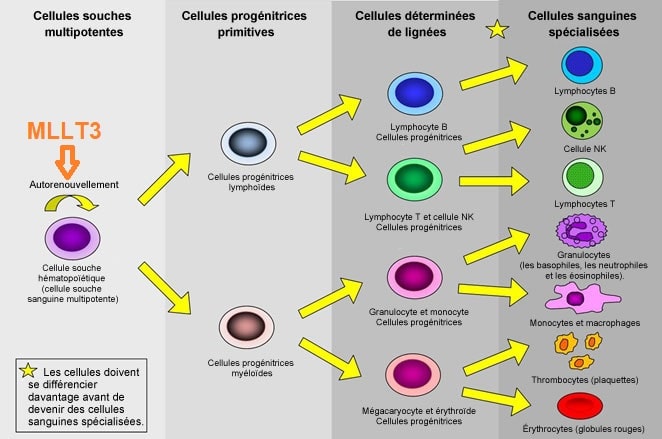
MLLT3 : un gène impliqué dans le renouvellement des cellules souches sanguines
Cela pourrait également permettre aux scientifiques de produire des cellules souches du sang à partir de cellules souches pluripotentes, susceptibles de créer n’importe quel type de cellules dans le corps. Dans le laboratoire, les chercheurs ont analysé les gènes qui s’éteignent lorsque les cellules souches du sang humain perdent leur capacité de s’auto-renouveler, en notant les gènes désactivés lorsque les cellules souches du sang se différencient en cellules sanguines spécifiques, comme des globules blancs ou rouges.
Ils ont ensuite placé les cellules souches du sang dans des boîtes de laboratoire et ont observé quels gènes étaient inactivés. En utilisant des cellules souches pluripotentes, ils ont fabriqué des cellules ressemblant à des cellules souches sanguines incapables de se renouveler et ont surveillé quels gènes n’étaient pas activés.
Ils ont découvert que l’expression d’un gène appelé MLLT3 était étroitement liée au potentiel d’auto-renouvellement des cellules souches du sang et que la protéine générée par le gène MLLT3 donnait aux cellules souches du sang les instructions nécessaires pour maintenir son aptitude à s’auto-renouveler. Pour ce faire, il collabore avec d’autres protéines régulatrices pour que des parties importantes de la machinerie des cellules souches du sang restent opérationnelles pendant la division cellulaire.
Sur le même sujet : Les cellules souches tendineuses pourraient révolutionner la guérison des blessures
Une multiplication des CSH plus importante grâce au gène MLLT3
Les chercheurs se sont demandés si le maintien du niveau de la protéine MLLT3 dans les cellules souches du sang dans des boîtes de laboratoire serait suffisant pour améliorer leurs capacités d’auto-renouvellement. En utilisant un vecteur viral — un virus spécialement modifié, capable de transmettre des informations génétiques au noyau d’une cellule sans causer de maladie — l’équipe a inséré un gène actif MLLT3 dans des cellules souches sanguines et a observé que les cellules souches sanguines fonctionnelles étaient capables de se multiplier au moins douze fois plus.


D’autres études récentes ont identifié de petites molécules — des composés organiques souvent utilisés pour créer des médicaments pharmaceutiques — qui aident à la multiplication de cellules souches du sang humain en laboratoire. Lorsque l’équipe de Mikkola a utilisé ces petites molécules, elle a constaté que l’auto-renouvellement des cellules souches sanguines s’améliorait en général, mais que les cellules ne pouvaient pas maintenir les niveaux de MLLT3 appropriés et qu’elles ne fonctionnaient pas aussi bien lorsqu’elles étaient transplantées chez la souris.
Un auto-renouvellement des cellules souches sanguines sans effets secondaires
Fait important, MLLT3 a permis aux cellules souches du sang de se renouveler elles-mêmes à un rythme raisonnable ; elles n’ont acquis aucune caractéristique dangereuse telle que la multiplication excessive ou la mutation et la production de cellules anormales pouvant conduire à la leucémie.
Les prochaines étapes pour les chercheurs consistent à déterminer quels protéines et quels éléments de l’ADN des cellules souches du sang influencent l’interrupteur marche-arrêt pour MLLT3, et comment cela peut être contrôlé à l’aide des ingrédients contenus dans les boîtes de laboratoire. Avec cette information, ils pourraient éventuellement trouver des moyens d’allumer et d’éteindre MLLT3 sans utiliser de vecteur viral, ce qui serait plus sûr pour une utilisation en milieu clinique.