Selon une équipe de chercheurs américains, un peptide humain incontrôlable appelé bradykinine pourrait être à l’origine des symptômes les plus sévères de COVID-19, pouvant conduire à la mort. Des médicaments permettant de contrôler le taux de bradykinine sont actuellement testés comme traitements chez des personnes atteintes par le coronavirus.
La bradykinine est une kinine naturelle, fabriquée par une enzyme libérée dans la sueur. Elle est connue pour ses propriétés vasodilatatrices et aide normalement à réguler la pression artérielle. Cependant, chez certaines personnes, le coronavirus semble doper la production de bradykinine et de ce fait, entraîne un déséquilibre au niveau des vaisseaux sanguins.
Des vaisseaux sanguins trop dilatés
Après la « tempête de cytokine », voici la « tempête de bradykinine ». Une équipe de chercheurs, dirigée par Daniel Jacobson du Oak Ridge National Laboratory dans le Tennessee, a récemment analysé des échantillons de liquide de lavage bronchoalvéolaire prélevés au début de la pandémie sur neuf personnes atteintes de COVID-19, à Wuhan. Puis, elle les a comparés à un groupe contrôle qui n’était pas malade. Les chercheurs ont alors constaté une surexpression des gènes responsables de la production de bradykinine.
Renuka Roche, de l’Université Eastern Michigan, dit que ce phénomène pourrait être à l’origine de nombreux aspects de la maladie, a priori sans liens apparents, tels que les douleurs pulmonaires, les symptômes neurologiques, ou encore le fait que les femmes soient d’une manière générale moins sévèrement atteintes que les hommes.
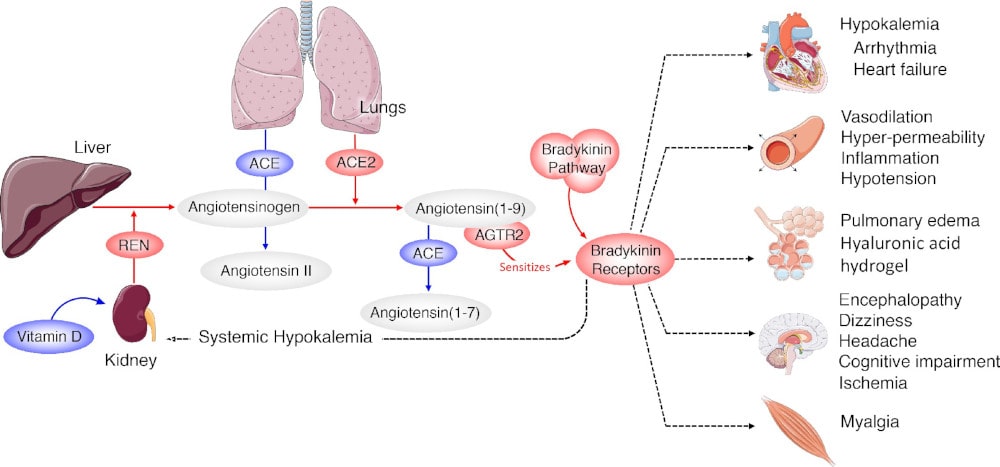
La bradykinine étant connue pour ses capacités à dilater les vaisseaux sanguins et les rendre plus perméables, les scientifiques pensent qu’un niveau trop élevé de cette substance peut entraîner une fuite de liquide dans les zones particulièrement denses en vaisseaux sanguins, comme les poumons. Elle peut aussi provoquer des douleurs, dues au gonflement et à l’inflammation des tissus environnants. De la même manière, cette surproduction pourrait outrepasser la barrière hématoencéphalique — qui sépare le système nerveux central de la circulation sanguine — ce qui expliquerait les étranges symptômes neurologiques observés chez plusieurs patients (anosmie, accident vasculaire cérébral, troubles de la conscience, etc.).
Selon Josef Penninger, directeur du Life Sciences Institute à l’Université de la Colombie-Britannique, au Canada, l’hypothèse est tout à fait plausible étant donné le mode d’action du SARS-CoV-2 sur l’organisme. En effet, le virus pénètre dans les cellules humaines via les récepteurs ACE2 (angiotensine II), qui contribuent également à contrôler les niveaux de bradykinine. Les récepteurs devenant moins disponibles, les niveaux de bradykinine pourraient devenir incontrôlables.
Outre la surexpression des gènes liés à la production de bradykinine, l’équipe de Jacobson a fait une autre découverte dans les échantillons prélevés : ils ont identifié une surexpression des gènes codant pour une substance appelée acide hyaluronique, une macromolécule qui se trouve dans la plupart des tissus conjonctifs, épithéliaux et nerveux de l’organisme. Et inversement, ils ont constaté une sous-expression des gènes produisant les enzymes chargés de contrôler le taux de cette molécule.
Une combinaison d’effets aux conséquences graves
L’acide hyaluronique contribue notamment à la prolifération et à la migration des cellules. Or, lorsque l’acide hyaluronique se mélange à un liquide, comme les liquides que les vaisseaux sanguins peuvent déverser dans les poumons, il devient gélatineux (c’est d’ailleurs du fait de cette propriété particulière que la substance est parfois utilisée en médecine esthétique ou dans le traitement de l’arthrose du genou par exemple). L’acide hyaluronique peut absorber plus de 1000 fois son poids en eau !
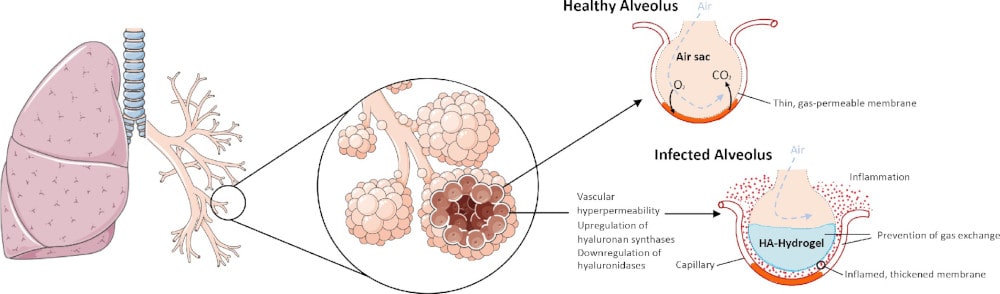
Ceci pourrait donc expliquer le symptôme sévère le plus notoire du coronavirus, à savoir les difficultés respiratoires : la fuite de liquide induite par la tempête de bradykinine, combinée à l’excès d’acide hyaluronique, entraînerait l’apparition d’une substance visqueuse gênant l’absorption d’oxygène (et la libération de dioxyde de carbone) dans les poumons. Le phénomène peut expliquer bien d’autres symptômes, notamment l’apparition de problèmes cardiaques chez des patients qui n’en avaient jamais connus auparavant.
Quant à l’apparente meilleure résistance des femmes face au virus, elle aussi trouve son explication dans cette étude : il se trouve que l’augmentation de bradykinine inhibe l’action d’une protéine impliquée dans le mécanisme de dissolution des caillots sanguins, la thymosine bêta-4 (ce qui explique les cas de coagulopathie fréquemment rapportés chez les patients COVID-19). Or, cette protéine se trouve sur le chromosome X, et les femmes étant dotées de deux chromosomes X, elles seraient deux fois plus « protégées » que les hommes.


Par chance, il existe des médicaments permettant de réguler les taux d’acide hyaluronique et de bradykinine, qui sont sur le marché depuis déjà quelques années. En 2011, la Food and Drug Administration avait ainsi approuvé l’icatibant, un médicament anti-inflammatoire, antagoniste des récepteurs B2 de la bradykinine ; il est notamment prescrit pour soulager les crises aiguës d’angio-œdème, une maladie héréditaire ou acquise qui se manifeste par l’apparition d’œdèmes sous-cutanés et/ou sous-muqueux transitoires et récidivants.
Sur le même sujet : Nous en savons enfin plus sur le mécanisme de coagulation sanguine provoqué par la COVID-19
En juillet, une équipe dirigée par Roger Brüggemann, du centre médical de l’Université Radboud aux Pays-Bas, a donc effectué un essai préliminaire d’icatibant sur neuf patients néerlandais atteints de COVID-19. Souffrant de difficultés respiratoires, ces patients étaient sous oxygène. Or, le traitement à l’icatibant a entraîné une réduction du besoin de supplémentation en oxygène chez huit de ces personnes ! D’autres études sont en cours aux États-Unis et en Europe afin de tester un médicament similaire, le Lanadelumab.
Selon Brüggemann, si les résultats se confirment, la prochaine étape consistera à mener un essai de plus large envergure, à l’échelle multinationale et impliquant plusieurs centaines de patients.