Des chercheurs révèlent que la fibrine, la composante principale des caillots sanguins, peut provoquer une coagulation anormale lors de l’infection au SARS-CoV-2 et enclenche le processus inflammatoire caractérisant la maladie. Cela contredit les précédentes hypothèses suggérant que l’inflammation aiguë est à l’origine des thromboses veineuses chez les patients COVID-19. La protéine affecterait également la capacité de l’organisme à éliminer le virus et pourrait ainsi expliquer certains symptômes du COVID long. Des essais cliniques de phase 1 pour un anticorps monoclonal agissant sur les propriétés inflammatoires de la fibrine ont déjà débuté.
La thrombose veineuse (la formation de caillots sanguins dans les veines) est l’une des complications les plus déroutantes de la COVID-19. En effet, elle peut à la fois survenir lors d’une infection aiguë et persister dans les cas de COVID long. Elle peut même survenir chez les jeunes patients ainsi que chez ceux asymptomatiques, augmentant le risque de mortalité. Les caillots sanguins qui en résultent sont particulièrement résistants à la dégradation, malgré l’utilisation d’anti-coagulants adéquats, ce qui suggère un mécanisme biomoléculaire jusqu’ici inconnu dans la pathogenèse de la maladie.
L’hypothèse dominante avance que la réaction inflammatoire aiguë provoquée par l’infection au virus est à l’origine de la thrombose veineuse. Cependant, « nous connaissons de nombreux autres virus qui déclenchent une tempête de cytokines similaire en réponse à l’infection, mais sans provoquer d’activité de coagulation sanguine comme celle que nous observons avec la COVID-19 », explique dans un communiqué Warner Greene du Gladstone Institute (à San Francisco).
Dans le cadre de la nouvelle étude, récemment publiée dans la revue Nature, Greene et son équipe se sont demandé si les caillots sanguins jouaient plutôt un rôle central dans la pathogenèse de la maladie, au lieu de constituer simplement un effet secondaire à la maladie. « Nous avons commencé à nous demander si les caillots sanguins jouaient un rôle central dans la COVID-19, si ce virus a évolué de manière à détourner la coagulation à son propre avantage », indique Katerina Akassoglou du Gladstone Institute et de l’Université de Californie à San Francisco, qui a dirigé l’étude avec Greene.
Un effet inflammatoire encore plus toxique dans le cas de la COVID
L’hypercoagulation sanguine observée dans la COVID est associée à une importante accumulation de fibrine au niveau des poumons et du cerveau. Il a été démontré qu’elle peut avoir des effets inflammatoires délétères. En atteignant des sites de lésions vasculaires et la barrière hémato-encéphalique, elle constitue un activateur pro-inflammatoire dans les maladies auto-immunes, inflammatoires et neurodégénératives.
En effet, les chercheurs de la nouvelle étude ont découvert que la fibrine a des effets inflammatoires encore plus toxiques dans le cas de la COVID, car elle se lie à la fois aux virus et aux cellules immunitaires. Cela crée des caillots sanguins inhabituels conduisant à une inflammation, une fibrose et une perte de neurones.
Lors d’essais sur des souris, la protéine de pointe du virus (aussi appelée « spicule » ou « protéine spike » et se liant aux récepteurs hôtes) se lie directement à la fibrine, ce qui provoque une anomalie dans la structure des caillots sanguins. À noter que la coagulation par la fibrine décrite dans l’étude est différente de celle associée à la complication thrombotique induite par certains vaccins à ADN.
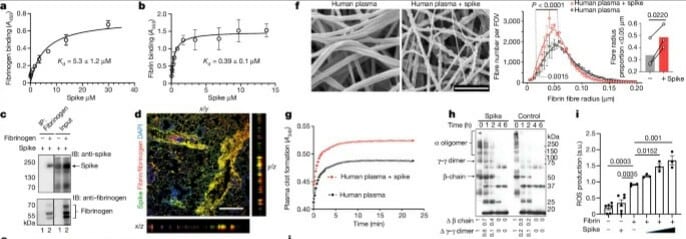
L’équipe a ensuite créé une mutation spécifique bloquant uniquement les propriétés inflammatoires de la fibrine, sans affecter sa capacité habituelle de coagulation sanguine. Les modèles murins de COVID génétiquement modifiés pour exprimer cette fibrine mutante ont montré une inflammation considérablement réduite. Le stress oxydatif, la fibrose et les caillots au niveau des poumons étaient également soit significativement réduits, soit inexistants.
En outre, les chercheurs ont constaté que la fibrine réduisait la capacité du système immunitaire à éliminer le virus (clairance virale). Elle réduit notamment l’activation des « natural killers (NK) », les cellules immunitaires spécialisées dans l’élimination des virus. Lorsque la production de fibrine a été désactivée chez les souris, les NK ont correctement éliminé le virus.
Étant donné que la fibrine s’infiltrant dans le cerveau est impliquée dans les maladies neurologiques, l’équipe de la nouvelle étude a cherché à savoir si elle pouvait aussi être liée aux symptômes neurologiques de la COVID. Leurs expériences ont montré qu’elle suractive les microglies — les cellules immunitaires du cerveau — chez les modèles souris de la maladie, tandis que son inhibition a un effet protecteur pour les neurones. Ce blocage a été efficace pour plusieurs souches de SARS-Cov-2.


Un traitement prometteur en essai clinique
Pour confirmer ces résultats, Greene et ses collègues ont développé un anticorps monoclonal agissant uniquement sur les propriétés inflammatoires de la fibrine. En administrant l’immunothérapie à des souris infectées, l’équipe a pu prévenir et traiter l’inflammation sévère et réduire la fibrose et les protéines virales au niveau des poumons. La perte de neurones ainsi que l’inflammation du cerveau ont aussi été significativement réduites. Le taux de survie a été considérablement amélioré.
« Sachant que la fibrine est à l’origine de l’inflammation et des symptômes neurologiques, nous pouvons tracer une nouvelle voie pour traiter la maladie à la racine », explique Akassoglou. « Dans nos expériences sur des souris, la neutralisation de sa toxicité sanguine par un traitement par anticorps anti-fibrine peut protéger le cerveau et le corps après une infection COVID », indique-t-elle.
Le traitement est en cours d’essais cliniques de phase 1 (incluant des personnes en bonne santé) au laboratoire pharmaceutique Therini Bio, pour évaluer son innocuité. La prochaine étape sera d’en évaluer l’efficacité sur des patients souffrant de la maladie et de sa forme longue. Ces derniers pourraient être sélectionnés en fonction de leur taux de fibrine sanguine, qui est considéré comme un biomarqueur prédictif de la déficience cognitive dans le COVID long.