L’attente fut longue, mais nous y sommes presque. À ce jour, plusieurs entreprises pharmaceutiques testent déjà des traitements antiviraux pour lutter efficacement contre la COVID-19. Le but dans un premier temps et de réduire considérablement les hospitalisations et les décès. C’est notamment le cas de Merck, qui pourrait bien devenir d’ici quelques mois le distributeur du premier traitement oral approuvé contre la COVID-19, après avoir montré dans une étude préliminaire qu’il permettait de réduire de moitié les hospitalisations, et de près de 100% les décès.
S’il est approuvé, le médicament antiviral serait la première pilule à administration simple dont l’efficacité contre la COVID-19 est démontrée, et marquerait une avancée majeure dans la lutte contre la pandémie. D’autres médicaments, comme la dexaméthasone, sauvent déjà la vie des patients hospitalisés les plus malades, mais doivent être administrés sous forme d’injections ou de perfusions.
Fabriquée par Merck (ou MSD en dehors des États-Unis) et Ridgeback Biotherapeutics, la molécule — connue sous le nom de molnupiravir et initialement conçue pour traiter la grippe — serait la première à pouvoir être prise à domicile par les patients à risque. Merck a déclaré qu’elle demanderait une autorisation d’utilisation d’urgence aux États-Unis dans les deux semaines à venir et qu’elle chercherait à obtenir le feu vert pour son utilisation dans plusieurs autres pays.
Une réduction des décès de près de 100%
Les experts prévoient que si d’autres données confirment les résultats initiaux des essais cliniques, le molnupiravir pourrait être approuvé pour le traitement des patients à haut risque quelques semaines après le dépôt d’une demande. « Cela a dépassé mes attentes, dans le cadre de cet essai clinique », a déclaré Dean Li, vice-président de la recherche chez Merck. « Lorsque vous constatez une réduction de 50% des hospitalisations ou des décès, c’est un impact clinique substantiel ».
L’essai a suivi 775 adultes atteints de Covid léger à modéré, considérés comme présentant un risque plus élevé de maladie grave en raison de problèmes de santé sous-jacents tels que l’obésité, le diabète ou les maladies cardiaques. La moitié d’entre eux ont reçu un traitement molnupiravir de cinq jours, qui se présente sous la forme de petites capsules brunes à prendre deux fois par jour.
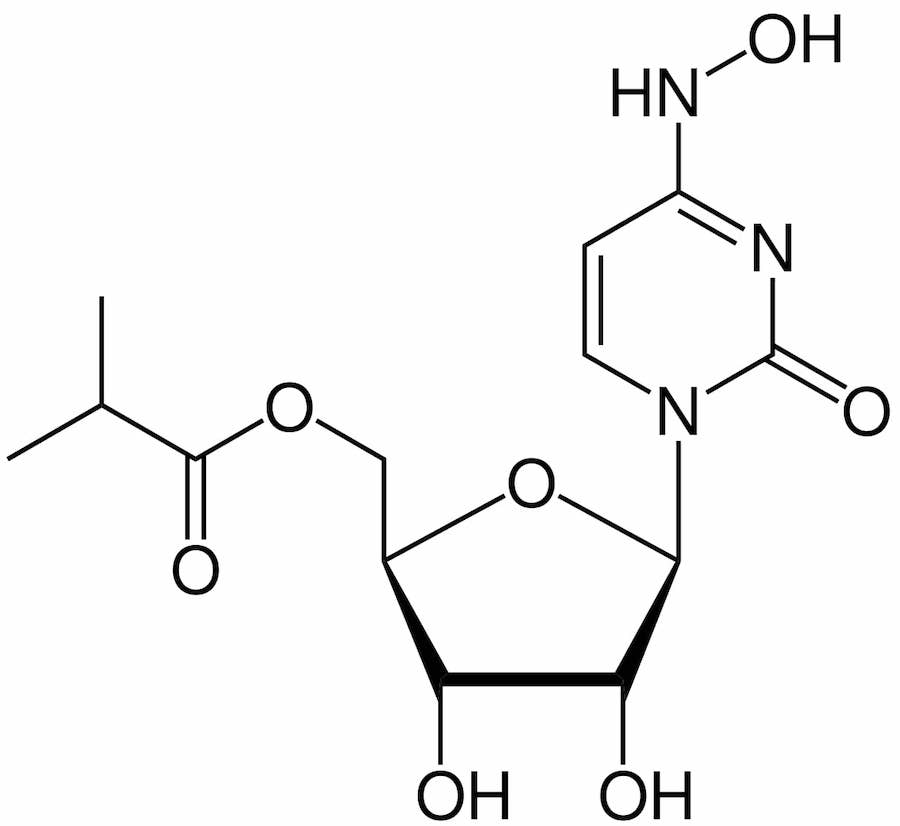
53 patients (14%) du groupe placebo ont été hospitalisés, contre seulement 28 (7%) de ceux qui ont reçu le médicament. Aucun décès n’est survenu dans le groupe traité par le médicament après cette période, contre 8 dans le groupe placebo, selon le laboratoire Merck. Soit une réduction des décès de 100%.
Les données de l’étude ont été rendues publiques dans un communiqué de presse vendredi et n’ont pas encore été examinées par des pairs. Toutefois, un groupe indépendant d’experts médicaux chargé de surveiller l’essai a recommandé de l’interrompre prématurément, car les résultats intermédiaires étaient très encourageants.
Un soulagement après la déception du remdésivir
Le professeur Peter Openshaw, de l’Imperial College de Londres, a qualifié le résultat de « remarquable s’il est confirmé », ajoutant que les essais décevants d’autres médicaments antiviraux tels que le remdésivir avaient réduit les attentes d’une percée. « Nous ne nous attendons pas vraiment à voir des données aussi impressionnantes pour un antiviral », a-t-il déclaré.
« C’est vraiment encourageant de voir des données cliniques positives dans un essai. Si les résultats se confirment, ce serait un résultat très positif », a déclaré le professeur Peter Horby, de l’Université d’Oxford. Horby a toutefois déclaré qu’il fallait être prudent, car avec un nombre relativement faible de participants, le chiffre de l’efficacité peut varier en fonction des résultats d’une poignée de patients.
Seules des informations limitées sur les effets secondaires ont été rendues publiques dans le communiqué de presse, mais la société a déclaré que les taux étaient similaires entre le groupe placebo et le groupe traité.
Une précommande de 1,2 milliard de dollars
Le gouvernement américain a acheté à l’avance 1,7 million de doses du médicament pour un coût de 1,2 milliard de dollars, et la société a déclaré vendredi qu’elle utiliserait une « approche de tarification échelonnée » pour refléter la capacité des pays à payer le médicament.
Janet Scott, de l’Université de Glasgow, qui dirige l’essai d’un autre médicament antiviral, a qualifié ces résultats de « très intéressants ». « Idéalement, à l’avenir, nous espérons disposer d’un médicament bien toléré que les gens pourront acheter sans ordonnance et prendre dès le premier soupçon d’infection, avant même d’avoir le résultat du test, afin de pouvoir cibler la Covid-19 à un stade précoce », a-t-elle déclaré.
En France, les cas COVID sont en baisse, avec 4935 nouveaux cas relevés hier. Le taux d’incidence évolue de façon mitigée : dans l’Aude par exemple, alors qu’il était de 68,4 pour 100 000 habitants sur semaine glissante du 21 au 27 septembre, il augmente, passant à 71,9 sur la semaine glissante du 22 au 28 septembre. En Pyrénées-Orientales, c’est une diminution qui est observée ; il passe de 53,7 à 50,9 sur les mêmes périodes. Les chiffres nationaux montrent cependant une diminution du nombre de patients en soins intensifs : 1414 hier, alors que le pays affichait 46 nouveaux décès pour 4935 nouveaux cas.


