Des chercheurs ont identifié un complexe protéinique servant « d’interrupteur » pour activer et désactiver l’enzyme cyclique GMP-AMP synthase, la sentinelle détectant les ADN pathogènes et enclenchant la réponse immunitaire. La régulation de cette voie est essentielle pour empêcher le système immunitaire d’attaquer les cellules de l’organisme. Le ciblage de ce complexe pourrait à la fois ouvrir la voie à de nouvelles stratégies contre les maladies auto-immunes et aider à améliorer l’efficacité des immunothérapies contre le cancer.
La pénétration d’un corps étranger dans notre organisme enclenche une cascade complexe de réponses, régie par le système immunitaire. Parmi les principaux composants de cette cascade figure l’enzyme cyclique GMP-AMP synthase (cGAS), qui agit en tant que sentinelle pour détecter l’ADN des pathogènes ou des cellules défectueuses (en cas de cancer). Au cours de la mitose, lorsque l’enveloppe nucléaire se désassemble, la cGAS est rapidement recrutée à l’intérieur du noyau et se lie aux nucléosomes.
Une fois liée au nucléosome, l’enzyme est généralement inactivée en l’absence d’ADN étranger (ou aberrant). Cet état est obtenu par le biais d’une liaison étroite au niveau d’un site spécifique de la chromatine. D’autre part, le nucléosome bénéficie d’une protection supplémentaire en raison de la présence d’une protéine architecturale appelée BAF, qui protège l’ADN double brin de la liaison active avec la cGAS. La liaison avec le nucléosome et la compétition avec les protéines architecturales de la chromatine empêchent conjointement l’activation du cGAS par l’ADN génomique hôte.
L’ensemble de ce processus doit être finement régulé afin de ne pas déclencher de réponse auto-immune, caractéristique des maladies inflammatoires, affectant environ 10 % de la population mondiale. « Il représente un équilibre sophistiqué entre la préparation immunitaire et la protection de l’intégrité du génome cellulaire », expliquent dans un communiqué les chercheurs, de l’École Polytechnique Fédérale de Lausanne (EPFL), en Suisse.
Cependant, la manière dont les cellules coordonnent la présence de la cGAS au niveau la chromatine et les réponses enclenchées, est en grande partie incomprise. « La question est de savoir comment la cellule coordonne cela avec ses autres fonctions quotidiennes », déclarent les experts de l’EPFL, qui ont exploré la question dans une nouvelle étude récemment parue dans la revue Nature.
Une cible prometteuse pour les maladies auto-immunes
Afin d’étudier comment la cGAS interagit avec le nucléosome, les chercheurs ont utilisé des techniques avancées d’imagerie moléculaire sur des cellules vivantes. Les interactions entre l’enzyme et les différents complexes protéiniques ont été observées au niveau atomique à l’aide de la biologie structurale, la biochimie et la biologie cellulaire.
Ils ont constaté qu’au cours de la mitose, l’enzyme migrait rapidement vers le noyau pour se lier au nucléosome, conformément aux précédentes observations. Puis, le taux de cGAS nucléaire diminue progressivement à mesure que le cycle de division cellulaire se poursuit. Parallèlement, le niveau cytosolique de l’enzyme augmente.
La liaison de la cGAS avec le nucléosome est médiée par un complexe protéique appelé CRL5-SPSB3, dont l’activation enclenche la destruction du noyau en présence d’ADN pathogène ou aberrant. Plus précisément, le CRL5-SPSB3 ajoute de l’ubiquitine (une autre protéine) au cGAS, afin d’activer la voie de signalisation de l’interféron de type 1 (IFN1), qui est nécessaire à la destruction des complexes protéiniques toxiques. « L’interférence avec la dégradation du cGAS nucléaire régulée par SPSB3 prépare les cellules à la signalisation de l’interféron de type I, conférant une protection accrue contre l’infection par des virus à ADN », ont écrit les experts dans leur étude.
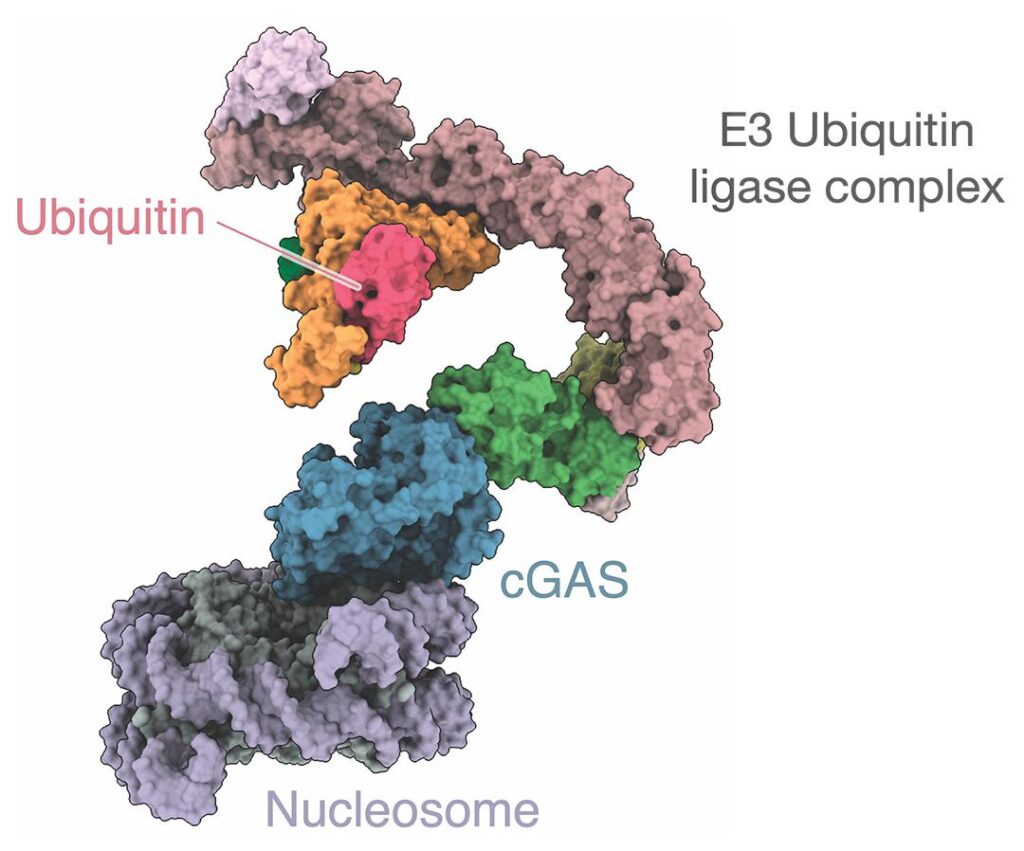
D’un autre côté, « l’ubiquitination » du cGAS induit également sa désactivation progressive, à mesure que les complexes protéiniques toxiques sont dégradés. En outre, le CRL5-SPSB3 désactive rapidement l’enzyme lorsque les cellules sont saines. Cela signifie que ce complexe agit comme un interrupteur activant ou désactivant la cGAS selon les besoins de la cellule.
Ces résultats suggèrent que ce complexe de protéine pourrait être une cible thérapeutique prometteuse, à la fois contre les maladies auto-immunes, le cancer et les infections chroniques. Ces affections se caractérisent notamment soit par une réponse immunitaire exacerbée, soit par un système immunitaire qui n’est pas suffisamment actif. Toutefois, davantage de recherches seront nécessaires afin de déterminer exactement comment contrôler cette voie de manière ciblée et efficace.