Des chercheurs ont découvert une forme de vie de nature extrêmement rare née de la fusion d’une algue avec une bactérie fixatrice d’azote il y a 100 millions d’années. Appelé endosymbiose primaire, le phénomène se produit lorsqu’un organisme en engloutit un autre pour faire de celui-ci un organite, à l’instar des mitochondries et des chloroplastes. Il s’agit du troisième cas recensé d’endosymbiose. Il pourrait ouvrir la voie à une production plus durable d’azote pour l’agriculture.
Au cours des 4 milliards d’années de vie sur Terre, seulement deux cas d’endosymbiose primaire étaient connus jusqu’ici. La première s’est produite il y a 2,2 milliards d’années, lorsqu’une archée a absorbé une bactérie pour l’intégrer dans son arsenal métabolique en la convertissant en mitochondrie. Cette étape constitue une phase majeure dans l’évolution de tous les organismes sur Terre, leur permettant notamment d’évoluer vers des formes plus complexes.
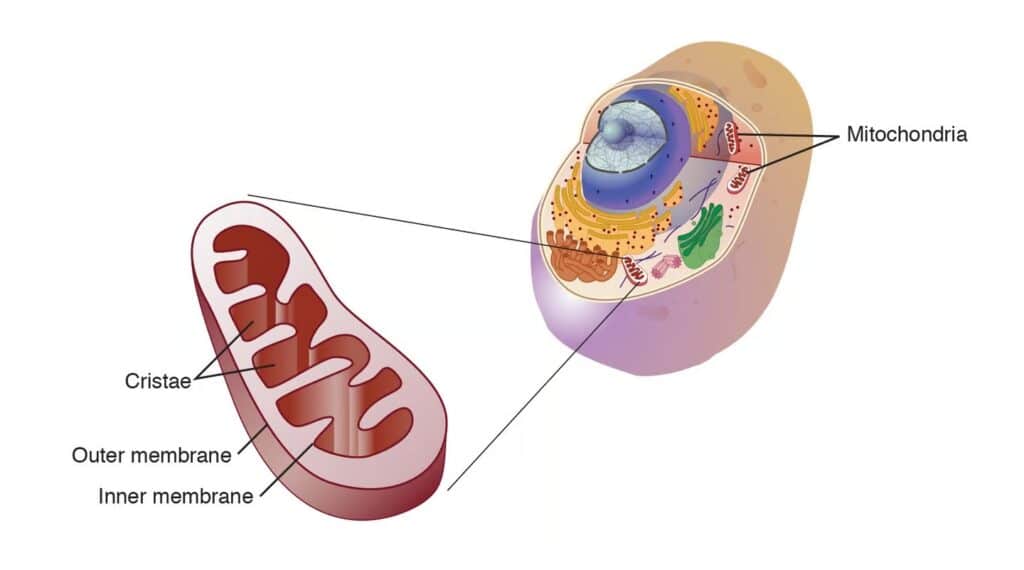
La seconde endosymbiose primaire connue s’est produite il y a 1,6 milliard d’années, lorsque des organismes unicellulaires ont absorbé des cyanobactéries capables de convertir la lumière en énergie (photosynthèse). Ces bactéries sont devenues les chloroplastes que les plantes chlorophylliennes utilisent encore à ce jour pour convertir la lumière du Soleil en énergie.
D’un autre côté, on pensait que seules les bactéries pouvaient extraire l’azote atmosphérique et le convertir en une forme utilisable (en ammoniac) pour le métabolisme cellulaire. Les plantes pouvant fixer l’azote (comme les légumineuses) effectuent ce processus en hébergeant ces bactéries au niveau de leurs nodules racinaires.
La découverte de l’équipe du Berkeley Lab bouleverse cette notion avec le premier organite capable de fixer de l’azote et intégré dans une cellule eucaryote (une algue marine). « Il est très rare que des organites résultent de ce genre de choses [endosymbiose primaire] », explique Tyler Coale de l’Université de Californie à Santa Cruz, dans un communiqué du Berkeley Lab. « La première fois que cela s’est produit à notre connaissance, cela a donné naissance à toute vie complexe. Tout ce qui est plus compliqué qu’une cellule bactérienne doit son existence à cet événement », a-t-il déclaré, en faisant référence aux origines des mitochondries. Le nouvel organite, décrit dans deux études publiées dans les revues Cell Press et Science, est baptisé «nitroplaste».
Un organite à part entière
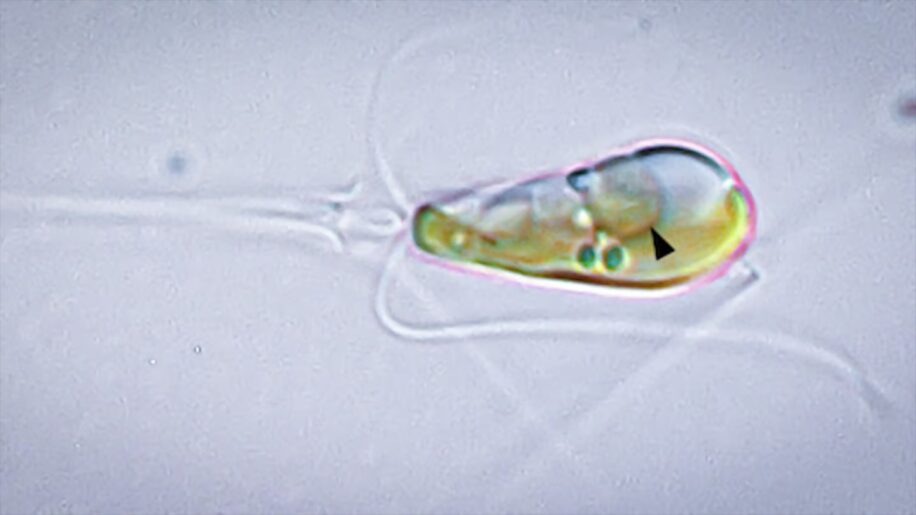
La découverte de l’organite a nécessité plusieurs décennies de travail. En 1998, les chercheurs ont identifié une courte séquence d’ADN qui semblait provenir d’une cyanobactérie fixatrice d’azote (UCYN-A) abondante dans le Pacifique. D’un autre côté, une autre équipe de l’Université de Kochi (au Japon) a identifié une algue marine (Braarudosphaera bigelowii) qui semblait être l’hôte symbiotique de la bactérie. En effet, l’ADN de cette dernière a été découvert en importante quantité dans les cellules de l’algue.
Alors que les chercheurs considéraient l’UCYN-A comme un simple endosymbiote de l’algue, les deux nouvelles études suggèrent qu’elle a co-évolué avec son hôte de sorte à devenir un organite à part entière. En effet, après plus de 300 expéditions, l’équipe japonaise est parvenue à isoler et cultiver l’algue en laboratoire. Cela a permis de montrer que le rapport de taille entre les UCYN-A et leurs algues hôtes est similaire d’une espèce à l’autre.
D’autre part, les chercheurs ont utilisé un modèle informatique pour analyser la croissance de la cellule hôte et de la bactérie par le biais des échanges de nutriments. Ils ont constaté que leurs métabolismes sont parfaitement synchronisés, ce qui leur permettrait de coordonner leur croissance. « C’est exactement ce qui se passe avec les organites », explique Jonathan Zehr, de l’Université de Californie à Santa Cruz et coauteur des deux études. « Si vous regardez les mitochondries et le chloroplaste, c’est la même chose : ils évoluent avec la cellule », ajoute-t-il.
Les experts ont également montré que la bactérie UCYN-A repose sur sa cellule hôte pour sa réplication protéique et sa multiplication. Pour ce faire, ils ont utilisé une technique d’imagerie à rayons X et une tomographie permettant d’observer les processus cellulaires en temps réel. « Nous avons montré grâce à l’imagerie à rayons X que le processus de réplication et de division de l’hôte algal et de l’endosymbiote est synchronisé », indique Carolyn Larabell, du Berkeley Lab.
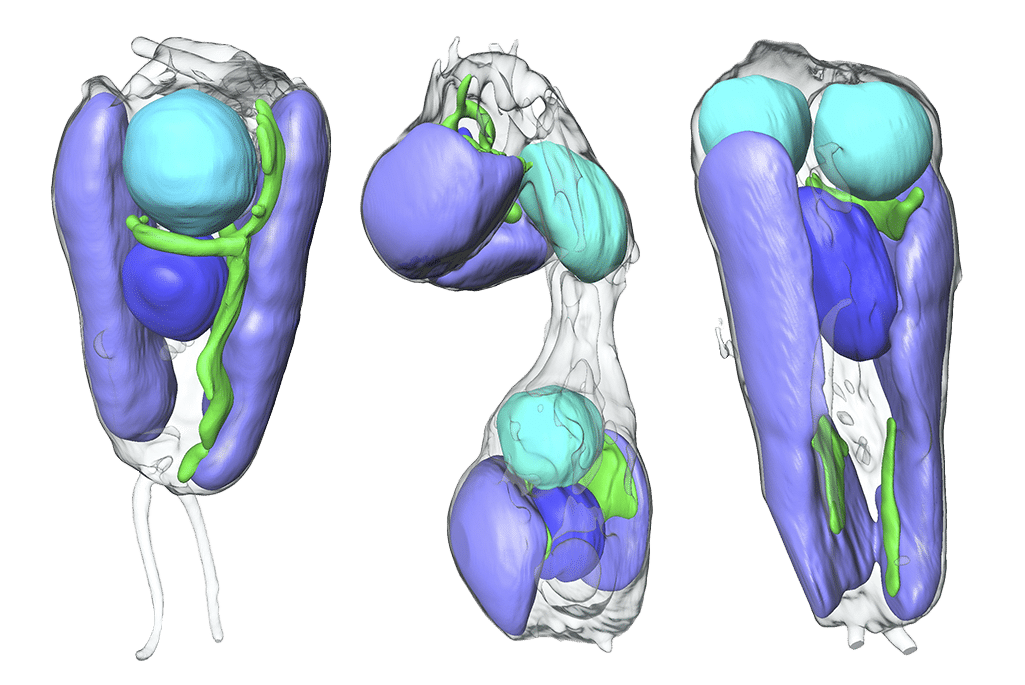
Une quantification des protéines des deux organismes a aussi été réalisée. Il a été constaté qu’environ la moitié des protéines de l’UCYN-A est synthétisée par sa cellule hôte, qui les marque avec une séquence protéinique spécifique. Ce marquage permet ensuite à la cellule de les envoyer au nitroplaste, qui les importe et les utilise pour son propre métabolisme. « C’est l’une des caractéristiques de quelque chose qui passe d’un endosymbionte à un organite », explique Zehr. « Ils commencent à éjecter des morceaux d’ADN, et leurs génomes deviennent de plus en plus petits, et ils commencent à dépendre de la cellule mère pour que ces produits génétiques soient transportés dans la cellule ».
Un potentiel pour une production d’azote plus durable
Les chercheurs estiment que les nitroplastes ont évolué il y a environ 100 millions d’années. Comme l’UCYN-A est présente dans presque tous les océans du monde, elle est probablement impliquée dans le cycle de l’azote atmosphérique. Cette découverte pourrait avoir d’importantes implications pour l’agriculture, le procédé industriel utilisé actuellement pour convertir l’azote atmosphérique en ammoniac (procédé Haber-Bosch) étant très énergivore. Ce dernier permet notamment d’assurer 50 % de la production alimentaire mondiale et est responsable d’environ 1,4 % des émissions carbone.
Toutefois, de nombreuses questions restent sans réponse concernant le nitroplaste et son hôte algal. En prochaine étape, les chercheurs prévoient ainsi de déterminer s’il est présent dans d’autres cellules ainsi que les effets que cela pourrait avoir. Cela pourrait permettre d’intégrer directement la fixation de l’azote dans les plantes de sorte à améliorer les récoltes.


 L’acide désoxyribonucléique, communément appelé ADN, est une molécule complexe qui joue un rôle essentiel dans la biologie des organismes vivants. Il contient les instructions génétiques utilisées dans [...]
L’acide désoxyribonucléique, communément appelé ADN, est une molécule complexe qui joue un rôle essentiel dans la biologie des organismes vivants. Il contient les instructions génétiques utilisées dans [...]